Thermodynamique
- prérequis
- 1er principe de thermodynamique
- quelques transformations particulières
- aide à la résolution de problèmes
- cycle de Carnot
- rendement
- entropie
- enthalpie, enthalpie libre
Prérequis
1ier principe de la thermodynamique
Soit un système fermé.
W = travail fournit (reçu) par le système = ∫ P . dV
Q = quantité de chaleur donnée (reçue) par le système
Il y 2 cas pour lesquels on dispose d'une formule :
- transformations isochores : CV . n . Δt
- transformations isobares : CP . n . Δt
U = énergie interne = fonction d'état
ΔU = variation de l'énergie interne = CV . n . Δt
1ier principe de la thermodynamique
ΔU = Q - W
Quelques transformations particulières
|
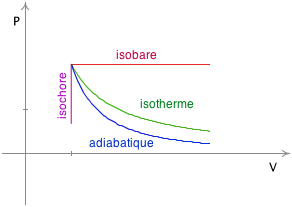
isotherme : T = cste et on a P . V = cste isochore : V = cste isobare : P = cste adiabatique : Q = 0 et on a P . Vγ = cste où \( \class{formule}{ γ = \dfrac{C_P}{C_V} }\) cycle : l'état final est le même que l'état initial (même P, V, T, n) |
 |
|
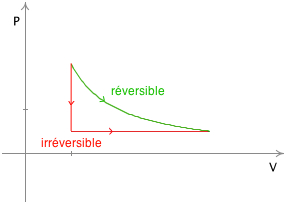
transformation réversible : transformation où tous les états intermédiaires sont des états d'équilibre. ⇒ isotherme : branche d'une hyperbole
transformation isotherme irréversible : Ti = Tf mais elle ne reste pas cste entre i et f. |
 |
Cycles
- cycle isotherme réversible : Wtot = 0, Qtot = 0
- cycle isotherme irréversible : Wtot < 0, Qtot < 0
Vous pouvez vous inspirer de cette aide à la résolution de problèmes.
Cycle de Carnot :
|
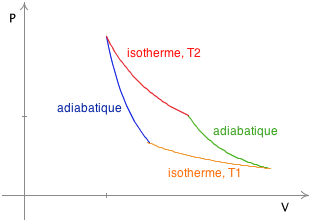 |
Rendement d'un moteur
Le rendement r = énergie produite / énergie fournie \( \class{formule}{ = \dfrac{W_{tot}}{Q_2} = 1 + \dfrac{Q_1}{Q_2} }\)
- pour un cycle réversible \( \class{formule}{ r = 1 - \dfrac{T_1}{T_2} }\)
- pour un cycle irréversible \( \class{formule}{ r' < 1 - \dfrac{T_1}{T_2} }\)
Entropie
Soit un système fermé.
L'entropie S est une fonction d'état.
\( \class{formule}{ ΔS = ∫ \dfrac{dQ_{rév}}{T} }\) ne dépend que des états i et f.
2ième principe de la thermodynamique: pour un système isolé
ΔS ≥ 0
- ΔS = 0 si transformation réversible
- ΔS > 0 si transformation irréversible
Enthalpie - enthalpie libre
On définit aussi une autre fonction d'état, l'enthalpie H = U + P . V
A P cste, ΔH = Q ⇒ surtout utilisée en chimie pour caractériser les réactions chimiques :
ΔH < 0 : réaction exothermique, chaleur dégagée
ΔH > 0: réaction endothermique, chaleur absorbée
H fonction d'état ⇒ loi de Hess : La variation d'énergie des processus chimiques ou physiques est indépendante du chemin suivi ou du nombre d'étapes nécessaires pour compléter le processus tant que les états initial et final de la réaction sont les mêmes.
Pour un système non-isolé, il est plus pratique d'utiliser encore une autre fonction d'état, l'enthalpie libre G.
G = H - T . S
Pour les transformations avec P et T constantes (comme celles se produisant dans l'air): ΔG = 0.
En général : ΔG ≤ 0