Théorie cinétique des gaz
- prérequis
- gaz parfaits
- vitesses des molécules
- pression, volume et énergie cinétique en fonction de la température
- mélange de gaz
- gaz réel: formule de Van der Waals
Prérequis
Gaz parfaits
3 conditions :
- taille des molécules telle qu'on peut les considérer comme des points géométriques,
- molécules indépendantes les unes des autres,
- chocs entre les molécules parfaitement élastiques
Vitesses des molécules
vitesse la plus probable : vitesse moyenne : vitesse quadratique moyenne : |
distribution selon la loi de Maxwell-Boltzmann ⇒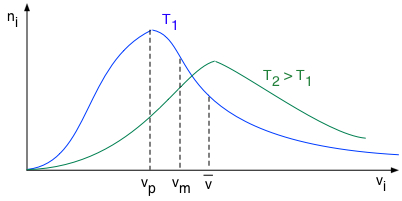 |
\( \class{formule}{ v_p = \sqrt{ \dfrac{2 . k . T }{m}} }\) \( \class{formule}{ v_m = \sqrt{ \dfrac{8 . k . T }{π . m}} }\) \( \class{formule}{ \overline{v} = \sqrt{\dfrac{3 . k . T}{m}} }\) |
énergie cinétique totale : \( \class{formule}{ E_K = \dfrac{M . \overline{v}^2}{2} }\)
pression : \( \class{formule}{ P = \dfrac{1}{3} . ρ . \overline{v}^2 }\)
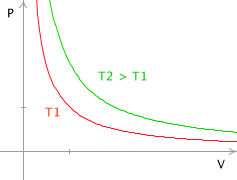
Pression et volume en fonction de la température :
1) A température constanteloi de Boyle-Mariotte : P . V = cste |
 |
2) Effets de la chaleur sur les gaz
loi de Gay-Lussac : à V cst, \( \class{formule}{ P = P_0 . \dfrac{T}{T_0} }\)loi de Charles : à P cste, \( \class{formule}{ V = V_0 . \dfrac{T}{T_0} }\)
loi des gaz parfaits : P . V = n . R . T
où- T0 = 273 K, P0 = 1 atm, V0 = 22,4 l,
- R = cste des gaz parfaits = 0,082 l.atm/mol.K = 8,31 J/mol.K = 1,98 cal/mol.K
Energie cinétique d'une mole : \( \class{formule}{ E_K = \dfrac{3}{2} . R . T }\)
- Energie cinétique d'une molécule : \( \class{formule}{ E_K = \dfrac{3}{2} . k . T }\)
- où k = cste de Boltzmann \( \class{formule}{ = \dfrac{R}{N} }\)
- et N = nbre d'Avogadro = 6 . 1023
Mélange de gaz
Soit un gaz i d'un mélange, caractérisé par son nombre de moles ni, son volume partiel Vi, sa pression partielle Pi.
Pour le mélange, n = ∑ ni
On définit :
composition volumique : \( \class{formule}{\dfrac{V_i}{∑ V_i} }\)
Et on montre les relations suivantes :
- P = ∑ Pi ,V = ∑ Vi
- \( \class{formule}{\dfrac{V_i}{V} = \dfrac{n_i }{n} }\)
- \( \class{formule}{ P_i = P . \dfrac{n_i}{n} = P . \dfrac{V_i}{V} }\)
Formule de van der Waals
gaz réel ⇒pas indépendantes : force d'attraction de van der Waals entre les molécules du gaz ⇒ pression diminuée
⇒ la loi des gaz parfaits doit être modifiée :
| gaz parfait | gaz réel |
|---|---|
| \( \class{formule}{ P . V = n . R . T }\) | \( \class{formule}{ (P + \dfrac{n^2. a}{V^2}) . (V - n . b) = n . R . T }\) (= formule de van der Waals) |
b est le volume occupé par les autres molécules, appelé covolume.