Le noyau atomique
- prérequis
- l'atome, le noyau
- masse de l'atome
- masse du noyau, énergie de liaison
- fission, fusion
- stabilité du noyau
Prérequis
- mécanique : l'énergie
- électricité : force électrique de coulomb
L'atome, le noyau
|
atome = 1 noyau et Z électrons noyau = A nucléons = Z protons + N neutrons |
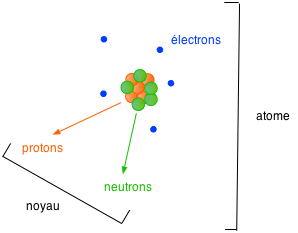 |
Z est appelé nombre atomique
A est appelé nombre de masse
N est simplement appelé nombre de neutrons
Masse de l'atome
masse de l'atome = masse du noyau + Z . masse de l'électron
Unité :
l'unité de masse atomique (u) avec \( \class{formule}{ 1 u = \dfrac{1}{12}~de~m(^{12}C)}\)
Masse du noyau, énergie de liaison
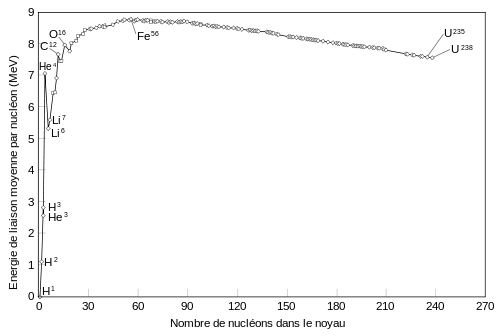
énergie de masse : E = m . c2 ⇒ 1 u = 931,478 Mev énergie de masse d'un noyau = masse du noyau . c2 = Z . mp + N . mn - A . Eli où Eli est l'énergie de liaison par nucléon |
 source: Wikimedia Commons |
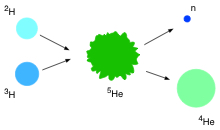
Fission, fusion
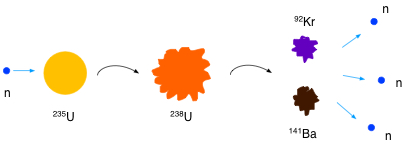
Il peut y avoir une réaction de fission si en fractionnant le noyau, l'énergie de masse devient plus faible, ce qui est le cas lorsque l'énergie de liaison par nucléon devient plus grande.
Il peut y avoir une réaction de fusion si en fusionnant deux noyaux, l'énergie de masse devient plus faible, ce qui est le cas lorsque l'énergie de liaison par nucléon devient plus grande.
Pour y parvenir, il faut fournir une énergie appelée énergie d'activation pour vaincre les forces électriques de répulsion des deux noyaux positifs.
Stabilité des noyaux
La stabilité des noyaux résulte d'un équilibre entre la force d'interaction forte (attraction), de courte portée, et la force électrique de répulsion entre les protons.
isotopes stables :
- N = Z pour les Z < 20,
- et un N peu plus grand que Z pour Z > 20
Voir ici la répartition sur un graphe N(Z) . Dans ce graphe, l'ensemble des isotopes stables sont répartis selon une ligne appelée ligne de stabilité.
Lorsqu'un isotope a plus ou moins de neutrons que l'isotope stable, il se désintègre selon différents processus (voir ici).