Emission de lumière
Prérequis
- mécanique : l'énergie
- phénomènes vibratoires : les ondes progressives
- optique : l'onde lumineuse
- rayonnements : quantification de l'énergie : le photon
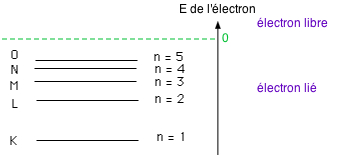
Modèle de Bohr
Les e- dans un atome peuvent être dans différents niveaux d'énergie de liaison (ou états ou couches ou orbites) : \( \class{formule}{ E = \dfrac{- K . Z^2}{n^2} }\)
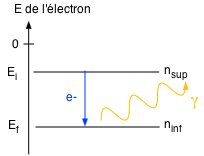
TransitionsDes e- peuvent descendre de niveau d'énergie de liaison (vers un niveau plus lié) ⇒ émission d'un photon d'énergie h . ν ( = lumière si cette fréquence est visible par l'oeil, voir ici) Par conservation de l'énergie : Ei = Ef + h . ν Pour l'atome d'hydrogène, on a la loi empirique (appelée formule de Rydberg) : \( \class{formule}{ \dfrac{1}{λ} = \dfrac{ν}{c} = R . ( \dfrac{1}{n_{inf}^2} - \dfrac{1}{n_{sup}^2}) }\) R = cste de Rydberg Pour tout autre atome, il suffit de multiplier cette grandeur par Z2. |
 |