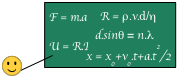Thermodynamique
loi des gaz parfaits P . V = n . R . T
travail W = ∫ P . dV
quantité de chaleur échangée avec le milieu extérieur:
Q = CV . n . (Tf - Ti) pour les transformations à V cst
Q = CP . n . (Tf - Ti) pour les transformations à P cste
Q = CP . n . (Tf - Ti) pour les transformations à P cste
variation d'énergie interne ΔU = CV . n . (Tf - Ti)
1er principe de la thermodynamique ΔU = Q - W
isotherme: T = cste ==> P . V = cste
adiabatique: Q = 0 ==> P . Vγ = cste où γ = CP / CV
rendement d'un moteur (T1 < T2): r = Wtot / Q2 = 1 + Q1/Q2
pour un cycle réversible r = 1 - T1/T2
pour un cycle irréversible r' < 1 - T1/T2
variation d'entropie ΔS = ∫ dQrév / T
Valeurs utiles:
R = 0,082 l.atm/mol.K = 8,31 J/mol.K = 1,98 cal/mol.K
Gaz monoatomique: γ = 5/3, CP = 5/2 . R, CV = 3/2 . R
Gaz diatomique: γ = 7/5, CP = 7/2 . R, CV = 5/2 . R