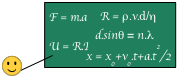(sauf thermodynamique)
Théorie cinétique des gaz:
vitesse quadratique moyenne \( \class{formule}{\overline{v} = \sqrt{\dfrac{∑ n_i . v_i^2}{n} } }\)
énergie cinétique d'un gaz \( \class{formule}{E_K = \dfrac{M . \overline{v}^2}{2} }\)
pression dans un gaz \( \class{formule}{ P = \dfrac{1}{3} . ρ . \overline{v}^2 }\)
loi des gaz parfaits P . V = n . R . T
énergie cinétique d'une mole: EK = (3/2) . R . T
Pour les unités de la pression, voir la page sur l'hydrostatique.
Calorimétrie:
∑Q = 0
changement de température ==> Q = c . m . Δt
changement d'état ==> Q = L . m
Hygrométrie:
humidité relative h.r. = p / f = f(Tpt rosée) / f(Tamb)
Valeurs utiles:
1 J = 0,24 cal
ceau = 1 g/(cal.K)
R = 0,082 l.atm/mol.K = 8,31 J/mol.K = 1,98 cal/mol.K