Thermodynamique
Prérequis
Présentation
-
Dans le menu, choisissez "Intro".
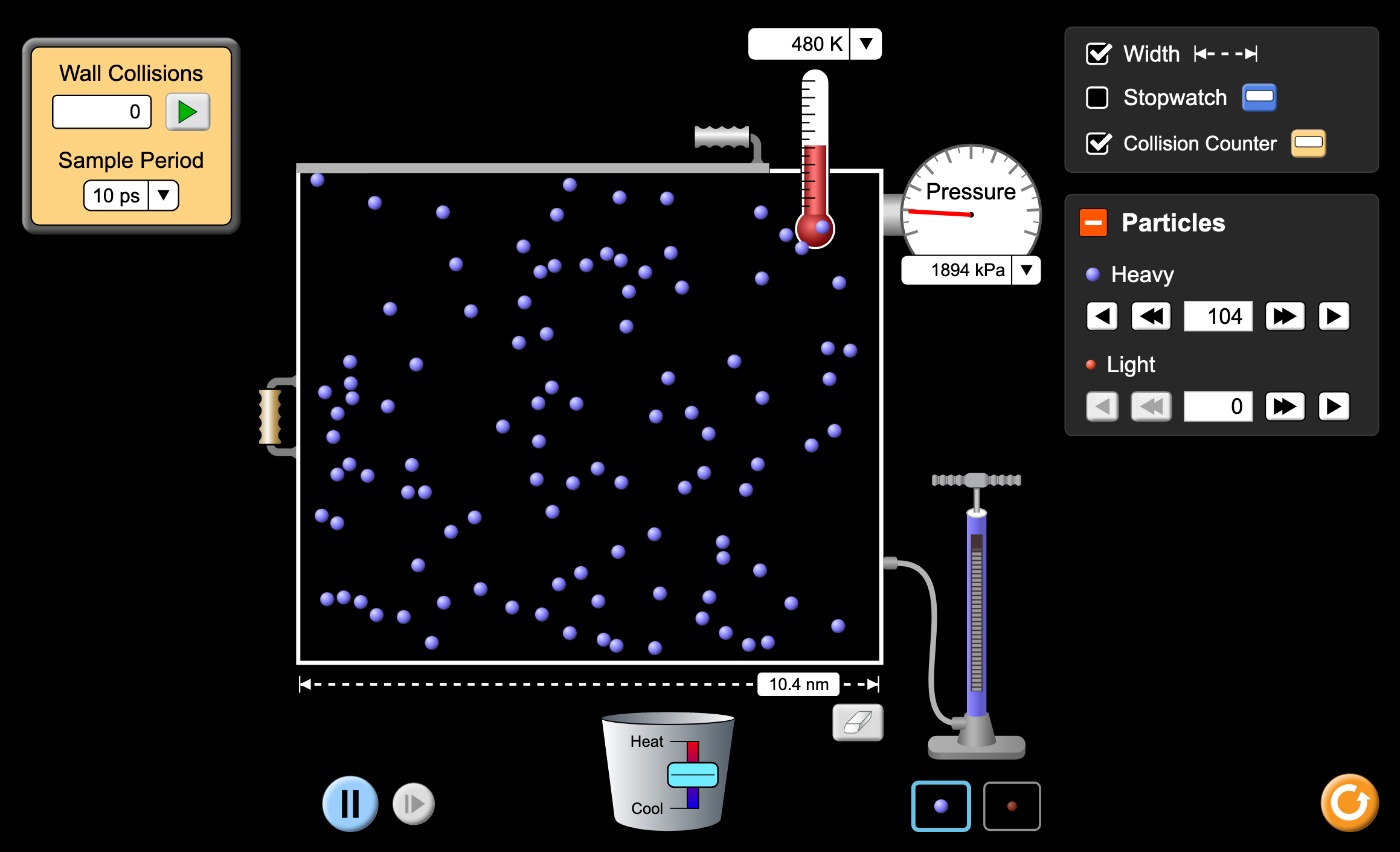
Le récipient a comme dimensions:
h = 4 nm
l = 8,75 nm
L variable entre 5 et 15 nm
(Cliquez sur la case "Width" en haut à droite pour faire apparaitre le mètre.)Injectez 1 particule dans le récipient.
A chaque collision, elle transmet une certaine quantité de mouvement à la paroi. Il en résulte une force exercée sur cette paroi et donc une force par unité de surface, qui est la pression.Ajoutez une seconde molécule. Qu'est-ce qui change ? Expliquez.
Mettez à présent 100 molécules. Qu'est-ce qui change ? Expliquez.
Doublez le volume en doublant la longueur L. Qu'est-ce qui change ? Expliquez.
Chauffez ce gaz jusqu'à quadrupler sa température. Que constatez-vous ? (mouvement des molécules, pression)
Refroidissez ce gaz le plus possible. Que constatez-vous ?
Chauffez ce gaz le plus possible. Que constatez-vous ?
Réinitialiser l'expérience. Mettez 100 molécules mauves (N2, m = 28 uma). Notez les valeurs de P et T.
Réinitialiser l'expérience. Mettez 100 molécules rouges (He, m = 4 uma). Que constatez-vous ? Expliquez.Vérifiez la loi des gaz parfaits (R = 8,31 J/K.mol)
Cochez "Collision counter".
Réinitialiser l'expérience. Mettez 400 molécules rouges (He, m = 4 uma). Notez les valeurs de la pression et de la température.
Ensuite, comptez combien il y a de collisions en 20 ps.
Par combien faut-il multiplier la température pour multiplier ce nombre par 2 ?
Vérifiez votre prédiction.
auteur : Simulations interactives PhET à l'Université du Colorado Boulder
-
Ensuite, dans le menu, choisissez "Laws".
Cette fois, vous pouvez maintenir un paramètre constant et voir ce qui change quand on en fait varier un autre.Vérifiez la loi de Boyle-Mariott en maintenant T constant (cochez la case "Temperature (T)") et en augmentant ou diminuant le volume (sans changer n bien sûr).
Vérifiez la loi de Charles en maintenant P constant (cochez la case "Pressure ↕T") et en augmentant ou diminuant le T (sans changer n).
Refaites-le mais cette fois en cochant la case "Pressure ↕V") et en augmentant ou diminuant V (sans changer n).Vérifiez la loi de Gay-Lussac en maintenant V constant (cochez la case "Volume (V)").