Jean-Christophe M. R. Monbaliu
Détail du projet
1.Objectif général du programme de recherche
Notre projet de recherche se situe en amont du processus de discovery en chimie médicinale et concerne une nouvelle approche de diversité moléculaire pour la construction de composés b-, g- et d-aminophosphoniques. Dans notre proposition, la chimie organique de synthèse sera développée en étroite synergie avec la chimie théorique afin d’ajuster au mieux les paramètres réactionnels.
Les dérivés a-aminophosphoniques, analogues phosphorés des a-aminoacides naturels, sont aisément accessibles et bien étudiés depuis plusieurs décennies [1]. Il n’en est pas de même pour leurs homologues b-, g- et d-aminophosphoniques étant donné l’absence de méthodes générales de synthèse de ces familles de composés. Or de nombreux produits naturels contenant ces motifs structuraux ont été isolés et ont montré des propriétés biologiques particulièrement intéressantes dans les domaines de la médecine et de l’agriculture [2].
En plus de leurs propriétés particulières, les dérivés phosphoniques sont souvent considérés comme des bioisostères des dérivés carboxyliques correspondants; le remplacement bioisostérique est une des techniques utilisées couramment pour l’optimisation d’un candidat-médicament. C’est dans ce contexte de recherche de méthodologies générales de synthèse donnant accès à de nouvelles diversités structurales et de processus d’optimisation de principes actifs que notre laboratoire a initié depuis plusieurs années [3] une recherche sur les composés b-, g- et d-aminophosphoniques. Notre thèse apportera une contribution originale dans ce domaine d’intérêt par le développement de synthèses asymétriques et le design de nouveaux réactifs fondé sur une étude théorique.
2.Stratégie scientifique
Notre approche est basée sur la réaction de Diels-Alder, réaction de cycloaddition [4+2] entre un diène et un diénophile, connue pour être très efficace, versatile et hautement régio- et stéréosélective lorsqu’elle se déroule selon un mécanisme concerté. Cette réaction offre également l’avantage d’une stratégie convergente, compatible avec un grand nombre de groupes fonctionnels, et susceptible d’être développée en version asymétrique grâce à l’utilisation d’auxiliaires chiraux ou de catalyseurs chiraux.
Nous avons donc considéré les cycloadditions [4+2] entre aminodiènes et phosphonodiénophiles, ou la situation inverse de réactions entre aminodiénophiles et phosphonodiènes, comme des voies privilégiées pour l’obtention d’une grande variété d’aminophosphonocyclohexènes, diversement fonctionnalisés, en tant que précurseurs potentiels d’acides b-, g- et d-aminophosphoniques. La formation sélective d’un seul régioisomère particulier dépendra uniquement de la position des substituants P et N sur les partenaires respectifs de la cycloaddition et ce, vis-à-vis d’autres substituants ancillaires choisis comme activants (groupement capteurs (EWG) ou donneurs (ERG) d’électrons) du diénophile ou du diène (Schéma 1)
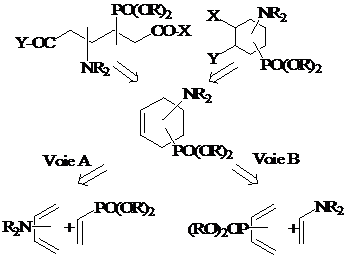
: Stratégie générale pour l’obtention de dérivés b-, g-, d-aminophosphoniques basée sur la cycloaddition de Diels-Alder
De façon assez surprenante, très peu de travaux, en dehors des publications de notre groupe, ont été consacrés aux réactions de Diels-Alder appliquées à des partenaires phosphoniques. Grâce à deux thèses précédentes, la faisabilité de la stratégie a été démontrée dans le cas de cycloadditions d’aminodiènes et de phosphoniénophiles [3c-e], ainsi que la possibilité de synthèse asymétrique [3g-h], ce que nous avons confirmé dans notre mémoire, avec une induction totale suite au développement d’une nouvelle copule chirale placée sur l’aminodiène.
Notre proposition de thèse, dans la lignée des travaux précités et de notre mémoire, se divise en deux parties.
2.1. Le premier volet concerne les cycloadditions entre aminodiènes et phosphonodiénophiles (Voie A, Schéma 1). Les aspects suivant seront considérés :
2.1.1. Synthèse de nouveaux cycloadduits
Dans la suite de notre mémoire de licence, nous allons étendre la synthèse régio- et stéréocontrôlée de dérivés b- et g-aminophosphoniques par cycloadditions entre les aminodiènes chiraux 1 et 2 et de nouveaux partenaires vinylphosphonates 5, 6 et 7 activés par un groupe électrocapteur (EWG) placé en position géminale ou vicinale (Figure 1).

Figure1: Partenaires des cycloadditions de Diels-Alder
2.1.2. Déprotections
Nous allons poursuivre l’étude d’une déprotection efficace et spécifique de la copule chirale, sur le premier lot de cycloadduits (préparés durant le mémoire; EWG = CO2Me, COMe et CN) et sur les nouveaux cycloadduits (EWG = CF3, NO2).
2.1.3. Valorisation des aminophosphonocyclohexènes
Après déprotection des groupements phosphonates et EWG (le cas échéant), nous disposerons de produits orignaux, énantiomériquement purs. On considèrera également la transformation de la double liaison C=C des cycloadduits (réduction, époxydation, dihydroxylation, clivage oxydatif) en vue de préparer des dérivés aminophosphoniques chiraux hautement fonctionnalisés (Figure 2).
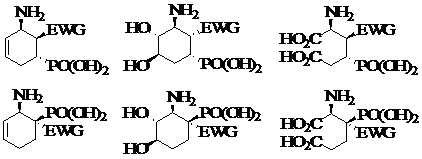
Figure2 : Produits représentatifs de la déprotection et de la transformation des cycloadduits
2.1.4. Nouveaux aminodiènes chiraux
L’introduction d’un substituant silyloxy en position 3 des diènes chiraux (diènes 3 et 4, Figure 1) devrait activer les cycloadditions de ceux-ci avec les vinylphosphonates 5-7 (EWG= COMe [4], CO2Me [5], CN [5], CF3 [6], NO2 [7]) et permettre d’accéder à des dérivés amino-phosphono-cyclohexanones.
2.1.5. Etude théorique (en collaboration avec le professeur D. Peeters)
Nous poursuivrons l’approche théorique du mémoire avec l’étude des états de transition des cycloadditions [4+2] entre le diène chiral 1 et l’éthylène, le propène et des vinylphosphonates.
2.2. Le second volet de notre thèse sera consacré à l’étude expérimentale et théorique des cycloadditions [4+2] entre phosphonodiènes et diénophiles aminés (voie B, Schéma 1). Les phosphonodiènes envisagés sont décrits dans la Figure 3.
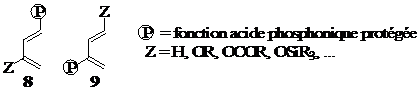
Figure3 : Phosphonodiènes
Les étapes de la réalisation seront les suivantes :
2.2.1. Préparation des phosphonodiènes [8]
Les 1- et 2-phosphonodiènes constituent des classes de réactifs très peu documentées à l’heure actuelle. Notre première tâche consistera donc à mettre au point des méthodes de synthèse des réactifs de type 8 et 9, avec possibilité d’activation par un groupement électrodonneur Z (Figure 3)
2.2.2. Etude théorique de la réactivité (en collaboration avec le Professeur D. Peeters)
Nous ferons appel aux méthodes de calculs ab initio pour étudier les différents états de transition de la cycloaddition des diènes 8 et 9 (Z = H) avec différents diénophiles. Les régio- et stéréosélectivités (endo/exo) seront étudiées, ainsi que la sélectivité faciale avec des partenaires chiraux. Les résultats de ces études devraient nous permettre de choisir plus judicieusement les réactifs à mettre en jeu dans les études expérimentales.
2.2.3. Etude expérimentale de la réactivité
Les diènes 8 et 9 seront opposés à des oléfines riches ou pauvres en électrons (énamines, nitrooléfines, ..) ainsi qu’à des hétérodiénophiles de types nitroso (O=N-R) et azo (R-N=N-R), en vue de fournir des séries de composés cycliques nouveaux (Figure 4).
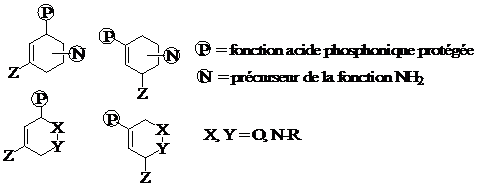
Figure4 : Cycloadduits de Diels-Alder
2.2.4. Synthèse asymétrique
Suite à une étude théorique, nous choisirons de placer la copule chirale soit sur le substituant P, soit sur le substituant N, c’est-à-dire sur le diène ou le diénophile. Les copules chirales envisagées sont décrites dans la Figure 5.
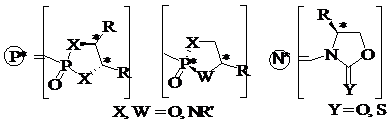
Figure 5 : Copules chirales
2.2.5. Valorisation des cycloadduits
Comme dans le premier volet de notre programme, les cycloadduits (en séries racémiques et chirales) subiront des transformations chimiques pour aboutir à des composés appelés drug-like : déprotections séquentielles des fonctions Z, P, N et autres (EWG et ERG), fonctionnalisations stéréocontrôlées de la double liaison C=C, clivage réductif des liaisons X-Y (O-N et N-N, Figure 4).
Les composés finaux seront évalués dans des tests biologiques d’orientation assez larges afin de détecter tout type d’activité. A l’issue de ces travaux, nous espérons être en mesure de proposer quelques nouvelles têtes de série à injecter dans la filière de recherche en chimie médicinale.
1] (a) Kabachnik, M. I.; Medved, T. Y.; Diatlyova, N. M.; Rudomini, M. V. Usp. Khim., 1974, 43, 1554-1574; (b) Redemore, R. Topics in Phosphorus Chemistry Vol VIII, 1976, Grayson M. and Griffith E. J., Interscience, N.-Y.-London; (c) Uziel, J.; Genet, J. P. Zh. Org. Khim., 1997, 39, 209-213
[2] (a) Kukhar, V. P.; Hudson, H. R. Aminophosphonic and Aminophosphinic Acids : Chemistry and Biological Activity, John Wiley & Sons, LTD, 1999; (b) Maier, L.; Diel, P. J. Phosphorus, Sulfur and Silicon, 1996, 109-110, 341-344; (c) Laurie, D. J.; Schoefter, P.; Wiederhold, K. H.; Sommer, B. Neuropharmacology, 1997, 36, 145-152; (c) Tanaka, J.; Kuwano, E.; Eto, M. J. Fac. Agr. Kyushu Univ., 1986, 30, 209-220; (d) Kuroda, Y.; Okuhara, M.; Goto, T.; Okamoto, M.; Terano, H.; Kohsaka, M.; Aoki, H.; Imanaka, H. J. Antibiot,. 1980, 33, 29-3; (e) Husson, M.-C.; Becker, A. Médicaments Anticancéreux, Ed. Médicales Internationales, 1995, 97-98 ; (f) Moloney, M.G. Natural Product Reports, 1998, 205; (g) Desos, P.; Lepagnol, J. M.; Morain, P.; Lestage, P. ; Cordi, A. J. Med. Chem., 1996, 39, 197.
[3] (a) Defacqz, N.; Touillaux, R.; Tinant, B.; Declercq, J.-P.; Peeters, D.; Marchand-Brynaert, J. J. Chem. Soc. Perkin Trans 2 1997, 10, 1965-1968; (b) Marchand-Brynaert, J.; Defacqz, N.; Robiette, R. "[4+2] Cycloadditions of phosphoryl-substituted dienes and dienophiles with a view of preparing aminophosphonic acid derivatives" In Recent Research Developments in Organic Chemistry, Transworld Research Network, Trivandrum, 2001, Vol. 5, p 207-223; (c) Defacqz, N.; Touillaux, R.; Marchand-Brynaert, J. J. Chem. Res. Syn. 1998, 9, 512-513; (d) Defacqz, N.; Touillaux, R.; Cordi, A.; Marchand-Brynaert, J. J. Chem. Soc., Perkin Trans 1 2001, 20, 2632-2637; (e) Robiette, R.; Defacqz, N.; Stofferis, J.; Marchand-Brynaert, J. Tetrahedron, 2003, 59, 4167-4175; (f) Robiette, R.; Marchand-Brynaert, J.; Peeters D. J. Org. Chem., 2002, 67, 6823-6826; (g) Robiette, R.; Marchand-Brynaert, J. J. Chem. Soc., Perkin Trans. 2, 2001, 2155-2158; (h) Robiette, R.; Cheboub-Benchaba, K.; Marchand-Brynaert, J.; Peeters D. J. Org. Chem., 2003, 68 9809-9812.
[4] Afarinkia, K.; Evans, M.; Graham, J. C. H.; Jimenez-Bueno, G. Tetrahedron Lett., 1998, 39, 433-434.
[5] Mc Clure, C.K.; Grote, C.W. Tetrahedron Lett., 1991, 32, 5313.
[6] (a) Nickson, E. T. J. Org. Chem., 1988, 53, 3870-3872; (b) Cen, W.; Yanchang, S. Journal of Fluorine Chemistry, 1995, 72, 107-110
[7] Baranov, G. M.; Perekalin, V. V. Zhurnal Obshchei Khimii, 1987, 57, 793-798.
[8] (a) Pudovik, A.N.; Konovalova, I.V. J. Gen. Chem. USSR 1961, 31, 1580; (b) Kosolapoff, G.M. J. Am. Chem. Soc. 1948, 70, 1974; (c) Christov, V.C. Phosphorus Sulfur and Silicon 1998, 132, 79-83; (d) Christov, V.C. Phosphorus Sulphur and Silicon 1998, 132, 73-77.