(hépatoblastome, hépatocarcinome, sarcome embryonnaire indifférencié, hamartome, Hémangioendothéliome , Hyperplasie focale nodulaire, adénome)
- Hépatoblastome [MIM 114 550]
Représente 1 à 2% des tumeurs malignes de l’enfant. Mutation somatique du gène APC (5q22.2). Tumeur d’origine embryonnaire qui atteint principalement l’enfant de moins de 2 ans. Elle est souvent associée à une malformation somatique comme :
- un syndrome de Beckwitt-Wiedemann
- une hémihypertrophie corporelle.
Les facteurs de risque sont une naissance prématurée (<1500 g), une polypose rectocolique familiale, un tabagisme durant la grossesse et une prééclampsie. Mais aussi : le syndrome de Li Fraumeni (voir ce terme) ou la trisomie 18.
Les signes sont en général une masse abdominale peu symptomatique découverte par hasard. La douleur et l’ictère sont rares. La présentation sous forme d’hémorragie intra-tumorale ou de rupture intra-péritonéale (à l’occasion d’un traumatisme) est exceptionnelle.
Une augmentation massive du taux sérique d’α-ftoprotéine est observée dans 75% des cas. Il peut exister des métastases pulmonaires. Deux syndromes paranéoplasiques sont parfois observés :
- une thrombocytose, par sécrétion de thrombopoïétine ;
- une pseudopuberté précoce, par sécrétion de â-HCG.
Selon l’histologie, on distingue :
- les formes purement épithéliales (la majorité des cas)
- les formes mixtes épithéliales et mésenchymateuses et, en fonction du contingent épithélial, quatre types histologiques sont individualisés : ftal, embryonnaire, à petites cellules indifférenciées et macrotrabéculaire.
Le traitement consiste en plusieurs cures de chimiothérapie (cisplatine, doxorubicine) suivies de la résection chirurgicale ou d’une transplantation hépatique si la tumeur n’est pas résécable (PRE-TEXT IV).
- Hépatocarcinome : [MIM 114 550]
Tumeur rare chez l’enfant. Sa fréquence augmente avec l’âge. Mutation somatique du gène CASP8 (2p33.1), CTNNB1 (3p22.1), PIK3CA (3q26.32, MET (7q31.2), PDGFRL (8p22), AXIN1 (16p13.3) ou TP53 (17p13.1). Elle survient parfois sur un terrain cirrhotique : hépatite B ou C, tyrosinémie I, glycogénose Ia (voir ces termes).
Les signes consistent en général en une masse abdominale douloureuse avec altération de l’état général. L’augmentation du taux sérique d’α-ftoprotéine est moins importante et moins fréquente qu’en cas d’hépatoblastome. Deux syndromes paranéoplasiques peuvent être observés :
- une polycythémie ;
- une féminisation chez le garçon.
Le pronostic est moins bon que celui de l’hépatoblastome et la chimiothérapie est moins efficace. Le traitement consiste en une résection chirurgicale ou une transplantation hépatique si la tumeur n’est pas résécable.
- Hépatocarcinome fibrolamellaire
Rarissime : représente 1 à 9% des tumeurs hépatiques. Variante histologique de l’hépatocarcinome, d’évolution très lente et qui se développe sur un foie sain. Les cellelues tumorales expriment en quantités importantes la protéine chimérique DNAJB1-PRKACA suite à une délétion au niveau du chromosome 19. Les taux sanguins de transcobalamine I et ou II sont élevés, ce qui permet de suivre l’évolution de la tumeur.
Tumeur rare de l’enfant de 6 à 10 ans. Il s’agit d’une masse abdominale d’allure kystique. Le pronostic est sévère : métastases pulmonaires, pleurales, péritonéales fréquentes.
- Tumeur rhabdoïde du foie [MIM 609 322, 613 325]
Très rare. En général chez le nourrisson ou le petit enfant. Tumeur sarcomateuse très agressive. Mutation germinale (transmission autosomique dominante d’une prédisposition familiale aux tumeurs rhabdoïdes) ou somatique du gène SMARCB1 (22q11.23).
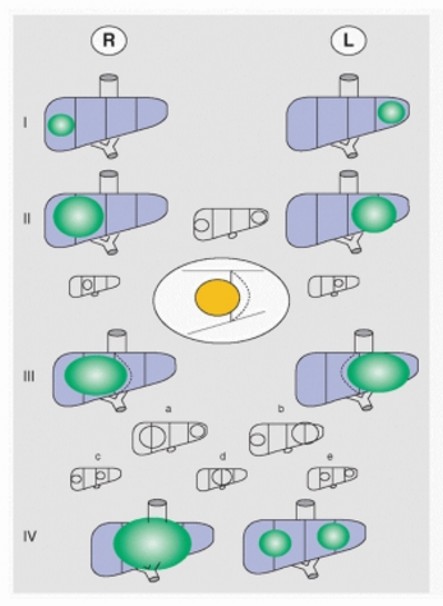
Pour toutes ces trois types de tumeurs malignes du foie, la mise au point radiologique permet un bilan d’extension pré-et post-chimiothérapie en fonction du nombre de secteurs hépatiques envahis, de l’envahissement des vaisseaux, d’une extension extrahépatique et de la présence de métastases : bilan PRET-EXT et POST-TEXT (SIOPEL)
- stade I : la tumeur ne touche qu’un seul secteur hépatique
- stade II : la tumeur touche deux secteurs hépatiques adjacents
- stade III : la tumeur touche trois secteurs hépatiques adjacents ou deux
- stade IV : la tumeur touche les quatre secteurs hépatiques
Les éléments suivants permettent d'affiner la stadification :
- E = une extension extra-hépatique de la tumeur 1, 2
- F = tumeur multifocale
- M = métastases : 1 si métastases à distance.
- V = atteinte des 3 veines sus-hépatiques : 1, 2, 3
- P = atteinte du tronc porte ou de ses 2 branches : 1, 2
- C1 = atteinte du lobe caudé (segment 1)
- R = rupture tumorale au moment du diagnostic
- N = atteinte ganglionnaire
Traitements possibles : cures de chimiothérapie suivies d’une hépatectomie plus ou moins étendue, chimioembolisation de la tumeur, embolisation préopératoire, transplantation hépatique.
- Hamartome mésenchymateux (Maladie des complexes de von Meyenburg)
Représente environ 8% des tumeurs hépatiques de l’enfant. Tumeur bénigne solide qui apparaît généralement avant l’âge de 2 ans. Elle est associée à une mutation du gène MALAT1(11q13), C19MC (19q13.4) ou, plus rarement, d’une mutation germinale ou somatique du gène DICER1 (14q32.13) (voir ce terme). Elle est soit appendue à un lobe hépatique (photo) soit bien encapsulée dans le foie.
En cas de multiples micro-hamartomes biliaires localisés dans les régions sous-capsulaires, on parle de maladie des complexes de von Meyenburg : ces lésions sont bénignes et se composent de petits canaux biliaires au sein d’un stroma fibreux fréquemment hyalinisé. Ils sont souvent asymptomatiques et ne nécessitent aucun traitement.

- Hémangio-endothéliome
Tumeur vasculaire qui apparaît durant les 6 premiers mois de vie puis présente une phase de croissance de 6 à 8 mois avant de se stabiliser puis d’entamer une régression spontanée lente à partir de l’âge de 18 mois-2 ans jusque vers 6-8 ans. C’est une lésion multifocale souvent accompagnée de lésions cutanées qui se présente sous la forme d’une hépatomégalie mais qui entraîner une décompensation cardiaque. À l’heure actuelle, le propranolol (associé ou on à la corticothérapie) est utilisé avec succès à la dose de 2 à 3,5 mg/kg/jour. On évite si possible la chirurgie (en général, la transplantation hépatique) qui est très hémorragique et grevée d’une mortalité et d’une morbidité importantes.
- Adénome
Tumeur bénigne, en général unique mais qui peut être multiple (« adénomatose hépatocellulaire ») qui est une complication tardive de la glycogénose Ia (une transformation maligne est possible en cas de mutation somatique du gène IGF2R (6q25.3)) III (maladie de Cori) ou IV, et de la â-thalassémie. Facteurs favorisants : diabète MODY 3, fistule portosystémique congénitale, utilisation d’androgènes anabolisants ou de contraceptifs oraux, polypose adénomateuse familiale, syndrome de Klinefelter.
Traitement : surveillance, risque de transformation maligne (10%).
- Hyperplasie focale nodulaire
Tumeur bénigne non évolutive, plus fréquente chez l’adolescente. Elle serait peut-être la conséquence d'une hypervascularisation localisée du foie. Chez la femme adulte, elle serait favorisée par la contraception orale.
Implications anesthésiques:
- en cas de chimiothérapies préopératoires : contrôle de l’hémogramme et de l’hémostase mais aussi ECG et échocardiographie pour vérifier la fonction myocardique.
- voir les examens préopératoires (échographie, CT-scan, parfois cavographie) nécessaires pour connaître l’anatomie précise, la vascularisation de la tumeur et ses rapports avec les gros vaisseaux, à la recherche d'une compression ou d'un envahissement de la veine cave inférieure (VCI).
- induction inhalatoire ou intraveineuse ; utiliser une sonde endotrachéale à ballonnet pour éviter des problèmes ventilatoires lors de la pose des écarteurs abdominaux. L’entretien est assurée par une ventilation contrôlée avec une PEP à l’aide d’un mélange O2/air associé à l’isoflurane ou au sévoflurane et un morphinique (fentanyl, sufentanil, en bolus répétés ou en perfusion continue).
- la fonction hépatique est habituellement normale (sauf en cas de cirrhose préexistante) et s’il n’y a pas de troubles de coagulation, l’association d’une anesthésie générale et d’une péridurale thoracique basse donne d’excellents résultats. Il faut cependant garder à l’esprit qu’en cas d’hépatectomie étendue une insuffisance hépatique plus ou moins importante, avec troubles modérés de l’hémostase et diminution des capacités métaboliques du foie, est inévitable durant les premiers jours postopératoires. Le rapport risque/bénéfice de la technique doit donc être évalué de manière individualisée
- monitorage invasif pour évaluer et compenser les pertes et les conséquences métaboliques d’une hépatectomie : mesure invasive de la pression artérielle, cathéter veineux central, sonde urinaire. Il est préférable de placer les voies veineuses aux membres supérieurs pour pouvoir continuer à assurer un remplissage vasculaire efficace en cas de clampage de la VCI. En cas d’extension intravasculaire tumorale de la VCI ou de l’oreillette droite (OD), l’intervention chirurgicale est généralement réalisée sous circulation extra-corporelle (CEC).
- pour faciliter la dissection chirurgicale, il est important d’éviter un remplissage vasculaire trop important car cela augmente la turgescence du réseau porte et de la VCI et donc le risque de saignement. Le remplissage est guidé par la valeur de pression artérielle systolique PAs et les variations de son pic avec la ventilation contrôlée mais aussi par l’observation du champ opératoire car certaines modifications sont dues aux manoeuvres chirurgicales : mobilisation du foie ou compression d’un gros vaisseau..
- en cas de clampage des vaisseaux du hile hépatique ou d’exclusion vasculaire du foie (clampage des vaisseaux du hile et de la veine cave inférieure supra- et intra-hépatique), le chirurgien doit d’abord procéder à un essai de clampage pour en observer les conséquences hémodynamiques et permettre d’adapter le remplissage de l’enfant avant le clampage définitif. Le clampage du hile est habituellement bien toléré si l’enfant n’est pas hypovolémique mais l’exclusion vasculaire requiert parfois l’administration de noradrénaline. Si un clampage prolongé est prévu, il est préférable de l’interrompre toutes les 15-20 minutes pour diminuer les séquelles ischémiques au niveau hépatocytaire.
- un risque d’embolie gazeuse ou tumorale est présent durant toute l’intervention, particulièrement durant la dissection et au moment du déclampage des vaisseaux hépatiques.
- cas particulier : la résection ex-situ de la tumeur (rare) : le foie est retiré en entier du patient (hépatectomie totale) et disséqué dans un liquide de conservation glacé pour pouvoir en ôter la masse tumorale. Étant donné l’absence d’hypertension portale, il faut alors prévoir une circulation extracorporelle partielle veino-veineuse pour maintenir le débit cardiaque durant cette phase d’anhépatie. On peut par exemple utiliser un introducteur de Swan Ganz 8 Fr placé dans une veine jugulaire interne : le bras latéral peut en être connecté stérilement au circuit de CEC héparinisé après cannulation des veines fémorale et porte, pour assurer le retour veineux splanchnique et des membres inférieurs au cur.
Un ictère et/ou de l’ascite peuvent se constituer durant les 2 à 5 premiers jours postopératoires.
D’autres complications hépatiques sont possibles:
- une hémorragie/ hématome sur la tranche de section ;
- une fistule biliaire sur la tranche de section : en l’absence d’extériorisation par un drain, le premier signe clinique est la douleur (irritation péritonéale par la bile) ; il faut également suspecter le diagnostic en cas d’élévation de la bilirubine plasmatique car l’écoulement de bile dans le péritoine est résorbé ;
- une décompensation hépatocytaire : à suspecter en cas d’hépatectomie étendue et/ou d’exclusion vasculaire totale du foie. La décompensation hépatique est signalée par une poussée ascitique, un ictère, des troubles de la conscience (encéphalopathie) et de la coagulation (INR et taux de facteur V bas).
Références :
- Mazereeuw-Hautier J, Hoeger PH, Benlarech S, Ammmour A, Broue P et al
Efficacy of propranolol in hepatic infantile hemangiomas with diffuse neonatal hemangiomatosis.
J Pediatr 2010 ; 157:340-2.
- Markiewicz-Kijewska M, Kasprzyk W, Broniszczak D, Bacewicz L, Ostoja-Chyzynska A, Ismael H, Kosciesza A et al
Hemodynamic failure as an indication to urgent liver transplantation in infants with giant hepatic hemangiomas or vascular malformations: report of four cases.
Pediatr Transplant 2009; 13:906-12.
- Przybylo HJ, Stevenson GW, Backer C, Luck SR, Webb CL, Morgan E, Hall SC.
Anesthetic management of children with intracardiac extension of abdominal tumors.
Anesth Analg 1994; 78:172-5.
- Lentschener C, Ozier Y.
Anaesthesia for elective liver resection : some points should be revisited.
Eur J Anaesthesiol 2002; 19:780-8.
- Dorman F, Sumner E, Spitz L.
Fatal intraoperative tumor embolism in a child with hepatoblastoma.
Anesthesiology 1985; 63:692-3.
Mise-à-jour juillet 2020