(Malaria)
Incidence en Europe et Amérique du Nord : 2,36/100.000 population/an. Mortalité en Afrique et en Asie : 7,5 à > 80/100.000/an. L’agent infectieux est en général Plasmodium falciparum en Afrique alors que P. vivax, ovale, malariae et knowlesi sont plus fréquents en Asie et dans les autres régions endémiques.
.jpg)
Le vecteur est le moustique anophèle femelle. Les sporozoïtes inoculés lors de la piqûre d’une femelle infectée se réfugient dans le foie où ils envahissent les hépatocytes et y produisent en 7-10 jours des schizontes qui contiennent des mérozoïtes (schizogonie extra-érythrocytaire). Les schizontes éclatent et libèrent des milliers de mérozoïtes qui entrent dans le courant sanguin et envahissent les globules rouges. Ces mérorozoïtes contiennent de se reproduire dans les globules rouges (schizogonie érythrocytaire) mais certains se transforment en gamétocytes mâles ou femelles. Ces mérozoïtes et gamétocytes font éclater les globules rouges qui les abritent, ce qui produit une hémolyse et une nouvelle libération de mérozoïtes dans le sang. Ces cycles d’infection des globules rouges durent environ 48h. Les gamétocytes présents dans le courant sanguin sont ingérés par l’anophèle lors d’une autre piqûre et le reste du cycle du parasite se déroule dans l’insecte (voir tableau).
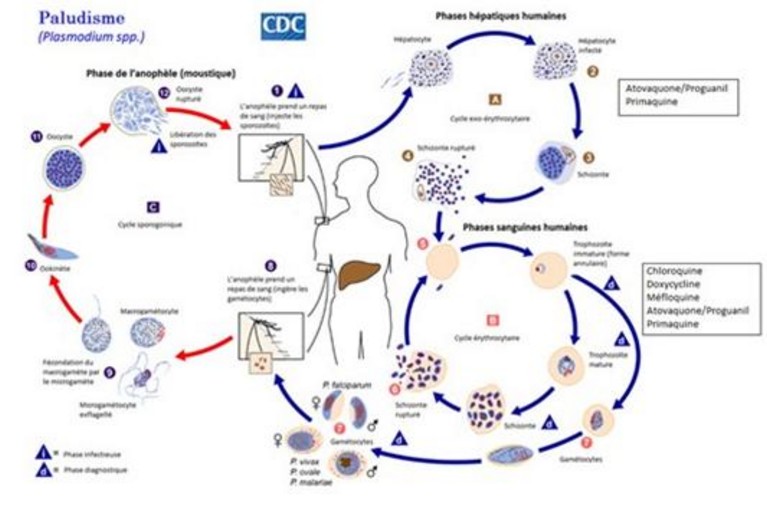
La période d’incubation varie de 5 jours à 4 semaines. Les manifestations cliniques de l’affection sont causées par ces accès d’hémolyse : crises de fièvre (frissons durant 1-2 h, suivis d’une hyperthermie majeure durant 3-4 h puis de sueurs profuses durant 2-4 h) qui réapparaissent toutes les 48 à 72h, et une hypoperfusion des organes car les shizontes adhèrent aux parois des petits vaisseaux et des capillaires. Durant leur cycle de maturation, P.vivax et ovale peuvent passer par un stade dit hypnozoïte qui permet au parasite de rester dans un état quiescent dans le foie durant une longue période avant une reprise de l’infection active
La sévérité des manifestations cliniques du paludisme est variable, de quasi asymptomatique (maux de tête) à des formes très sévères : anémie, thrombopénie, coagulopathie avec parfois déclenchement d’une CIVD, choc, insuffisance respiratoire, atteinte neurologique (neuropaludisme), hypoglycémie, insuffisance rénale aiguë.
Prévention:
- enduire la peau d’un produit répulsif avec DETT, ou sans; utilisation d’une moustiquaire
- médicamenteuse: selon la sensibilité des souches locales (voir les données du CDC par pays sur le site (https://www.cdc.gov>country_table) :
- malarone (atovaquone + proguanil): 1 jour avant et jusque 5 jours après retour d‘une zone endémique
|
poids (kg) |
cé adulte |
cé junior |
|
5-8 |
- |
1/2 |
|
8-10 |
- |
3/4 |
|
11-20 |
1/4 |
1 |
|
21-30 |
1/2 |
2 |
|
31-40 |
3/4 |
3 |
|
>40 |
1 |
- |
- doxycycline en cas d’intolérance à la malarone
- deux vaccins en cours de diffusion : RTS,S/AS01 et R21/MatrixM: injections répétées
- essais de l‘injection sous-cutanée d’un anticorps monoclonal (L9LS) dirigé contre une protéine de surface des sporozoïtes et exprimée lors de la phase préérythrocytaire: effet durant 6 mois
Implications anesthésiques:
- y penser : zone endémique, migrants ou retour de voyage (voir carte mondiale). Il y a parfois des récurrences post-opératoires après une longue période asymptomatique (surtout P vivax et P ovale).
- symptômes aspécifiques
- un examen sanguin négatif n’exclut pas le diagnostic
- en cas de goutte épaisse positive sans signes de paludisme : traiter et reporter l’intervention d’une semaine.
- en cas d’anesthésie durant un accès : surveiller la glycémie (risque d’hypoglycémie), éviter l’hypoventilation (risque d’hypertension intracrânienne en cas d’atteinte cérébrale) et la surchage volémique (dysfonction ventriculaire), et enfin : surveiller les plaquettes, l’hémoglobine et la fonction rénale (risque de nécrose tubulaire, d’hyponatrémie et d’hyperkaliémie)
- en cas de crise durant une anesthésie : diagnostic différentiel avec l’hyperthermie maligne
- traitement d’un accès sévère : suivre l’avis d’un infectiologue.
sinon, artésunate IV très lente ou IM : 3 mg/kg/dose si < 20 kg
2,4 mg/kg/dose si > 20kg
1 dose 12 et 24h après la 1ère dose puis 1 dose/j max 7j
relais par artémisinine p os, dès que possible
risque d’hémolyse 2-3 semaines après si hyperparasitémie ou jeune enfant
L’OMS recommande d’associer l’artésunate à un des antipaludiques suivants : méfloquine ; pyronaridine ; sulfadoxine-pyriméthamine ; artéméther-luméfantrine ; dihydroartémisinine-pipéraquine. Des cas de résistance partielle à artémisinine ont été décrits dans le Mékong, en Erythrée, en Ouganda et au Rwanda.
Références :
- Zanfini BA, Dell'Anna AM, Catarci S, Frassanito L, Vagnoni S, Draisci G.
Anesthetic management of urgent cesarean delivery in a parturient with acute malaria infection.
Korean J Anesthesiol 2016 ; 69 : 193-6.
- Soltanifar D, Carvalho B, Sultan P.
Perioperative considerations of the patient with malaria.
Can J Anesth 2015 ; 62:304–18
- Shafya SZ, Hakima M, Henga R, Tobias JD.
Anesthetic implications of malarial infection in a child.
J Med Cases 2019;10: 84-8
- Espina-Bertoso S.
Malaria for the anaesthetist.Tutorial 176.
Update in Anaesthesia, Sept 2010, p 24-7.
- Kayentao K, Ongoiba A, Preston AC et al.
Subcutaneous administration of a monoclonal antibody to prevent malaria.
N Engl J Med 2024;390:1549-59.
Mise-à-jour mai 2024