Tumeur solide la plus fréquente chez l’enfant après les tumeurs cérébrales : incidence estimée à 9,5 cas par million d’enfants et par année. Elle est dérivée de cellules de la crête neurale embryonnaire. Une mutation d’un des gènes suivants peut produire un neuroblastome : gène KIF1B en 1p36 (NBLST1, MIM 256 700), gène PHOX2B en 4p12 (NBLST2, MIM 613 013), gène ALK en 2p23 (NBLST3, MIM 613 014), un gène en 6p (NBLST4, MIM 613 015), un gène en 2q35 (NBLST5, MIM 613 016), un gène en 1q21 (NBLST 6, MIM 613 017). D’autres pathologies dues à des anomalies de la migration de la crête neurale peuvent y être associées : maladie de Hirchsprung, syndrome d’Ondine, neurofibromatose de type I. Selon le degré de maturation cellulaire des cellules tumorales, on parle de neuroblastome (peu de différentiation), de ganglioneuroblastome (différentiation intermédiaire) ou de ganglioneurome (forme différenciée et bénigne).
Le mode de présentation est très variable. La symptomatologie dépend de la localisation de la tumeur primitive et de la présence de métastases. Par ordre de fréquence, la tumeur primitive est située au niveau :
- abdominal : masse abdominale, parfois énorme chez le nourrisson, qui peut entraîner une détresse respiratoire et une compression vasculaire ;
- thoracique : problème respiratoire, syndrome de Claude Bernard-Horner ; elle est localisée dans le médiastin postérieur ;
- pelvien : masse, incontinence urinaire ou fécale ;
- cervical : masse compressive.
Quand la tumeur primitive est localisée près de l’axe vertébral, on observe souvent une extension tumorale jusque dans le canal médullaire qui peut entraîner des douleurs ou des signes de compression médullaire (troubles de la marche, paraplégie brutale).
Les métastases peuvent être :
- médullaires : anémie, leucopénie, thrombopénie ;
- hépatiques : insuffisance hépatique par envahissement ;
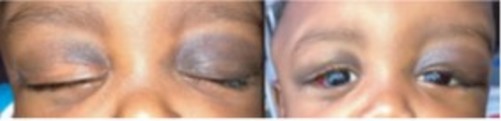
- rétro-orbitaires : exophtalmie associée à des ecchymoses périorbitaires (signe de Hutchinson); cette localisation est pathognomonique mais souvent attribuée initialement, à tort, à un traumatisme.
- mandibulaires : gonflement douloureux de la mâchoire
L’enfant peut également présenter des signes généraux comme :
- une hypertension artérielle, due à la compression des vaisseaux rénaux par la masse ou à la sécrétion tumorale de catécholamines (parfois accompagnée de sudations profuses)
- une diarrhée aqueuse, due à la sécrétion tumorale de VIP (Vasoactive Intestinal Peptide) et à l'origine d'une déshydratation avec hypokaliémie, hypochlorhydrie et hypercalcémie ;
- des signes neurologiques : syndrome de Kinsbourne ou opso-myoclonies (association de myoclonies incessantes et intenses, rendant impossibles les mouvements coordonnés, et d’opsoclonies qui sont des mouvements anarchiques, asymétriques et multidirectionnels des globes oculaires) (voir ce terme)
Les tumeurs qui secrètent du VIP ou qui entraînent des opso-myoclonies sont histologiquement plus matures et ont un meilleur pronostic. En général, les nourrissons présentent un stade L1 ou MS alors que les enfants âgés de plus d’un an présentent plus souvent un stade L2 ou M.
Un bilan initial d'extension est indispensable pour adapter le traitement. Ce bilan comprend, outre un bilan hématologique et une ponction-biopsie médullaire :
- la mesure des catécholamines urinaires : on retrouve des catécholamines ou leurs métabolites (acide homovanillique ou vanillylmandélique ou métanéphrine) dans plus de 90% des cas ; la présence d‘ acide vanillylmandélique et/ou de métanéphrine (dérivés du métabolisme de la noradrénaline) entraînent un risque beaucoup plus élevé d’hypertension peropératoire que la présence d’acode homovanillique (dérivé de la dopamine)
- la recherche de marqueurs sériques : énolase neurone-spécifique, LDH ;
- une scintigraphie au MIBG (méta-iodobenzylguanidine marqué à l’iode 123) qui confirme le diagnostic, permet de détecter des métastases et d’assurer un suivi après traitement.
Une biopsie de la tumeur est nécessaire pour rechercher des facteurs de gravité en fonction de l’aspect histologique (degré de maturation cellulaire), du contenu en ADN des cellules tumorales et de l’amplification du MYCN (oncogène situé en 2p24.3 et dont l’expression stimule la croissance tumorale).
Une nouvelle classification clinique a été établie en fonction du bilan d'extension préopératoire. Elle permet d’évaluer le risque vital et de proposer une stratégie thérapeutique. Les éléments cliniques sont pondérés par les résultats biologiques en sachant qu’une faible différentiation cellulaire, une amplification de NMYC ou un faible contenu en ADN sont des éléments péjoratifs.
|
Stade INRGSS International Neuroblastoma Risk Group Staging System |
Stade INSS International Neuroblastoma Staging System |
Définition |
Implications thérapeutiques |
|
L1 |
1 et 2 |
Tumeur localisée qui n’envahit pas des structures vitales (imagerie) et limitée à un compartiment du corps |
Exérèse chirurgicale possible |
|
L2 |
3 |
Tumeur locorégionale avec présence d’une ou plusieurs facteurs de risque d’envahissement local à l’imagerie |
Exérèse chirurgicale difficile à cause de l’envahissement de structures vitales |
|
M |
4 |
Toute tumeur avec métastases à distance (sauf MS) : ganglions, moelle osseuse, foie, autres organes |
Un traitement médical préopératoire agressif est nécessaire |
|
MS |
4S |
Tumeur chez un nourrisson de moins de 18 mois et métastases limitées au foie, à la peau et/ou à la moelle osseuse |
Intervention chirurgicale non nécessaire sauf complication vitale |
Système international de classification clinique du neuroblastome
La stratégie de traitement est établie au cas par cas :
- en cas de risque faible (stade L1 sans amplification de NMYC), la chirurgie seule est nécessaire ;
- en cas de risque élevé (stade L2 avec amplification de NMYC ou histologie défavorable, stade M), des cures de chimiothérapie (cyclophosphamide, vincristine, anthracycline) sont réalisées avant une exérèse chirurgicale quand la tumeur a diminué de volume ; cette exérèse est suivie d’autres cures de chimiothérapie et, idéalement, d’une transplantation médullaire autologue et, si nécessaire, d’une radiothérapie locale.
Le stade MS (parfois appelé syndrome de Pepper) est particulier car il ne nécessite, en principe, aucun traitement, sauf s’il présente une amplification de NMYC ou une histologie défavorable, puisque la tumeur régresse spontanément. Cependant, si la tumeur est très volumineuse et compromet le pronostic vital (détresse respiratoire, insuffisance hépatique), quelques cures de chimiothérapie sont réalisées pour accélérer la fonte tumorale.
De nouvelles modalités thérapeutiques (MIBG marqué à l’iode 131, acide rétinoïque etc…) sont en cours d’évaluation.
Implications anesthésiques:
- en préopératoire :
- échocardiographie pour évaluer la fonction myocardique qui peut être altérée par la chimiothérapie (anthracyclines) ainsi que par une éventuelle cardiomyopathie induite par l'excès chronique de catécholamines
- mesure des catécholamines urinaires (voir taux d’acide homovanillique ou vanillylmandélique ou de métanéphrine)
- bilan hématologique
Si la tumeur sécrète des catécholamines, il faut administrer un traitement antihypertenseur préopératoire pour compenser progressivement l’hypovolémie induite par la vasoconstriction et prévenir ou améliorer une cardiomyopathie par excès chronique de catécholamines. Le traitement le plus utilisé est à base d'anti-calciques (nifédipine ou nicardipine, par exemple).
- en périopératoire :
- durant les procédures de diagnostic et d’évaluation de la tumeur : risque d’hypertension lors de l’intubation trachéale ou de la palpation de la tumeur,
- et risque d’hypotension due au syndrome cave réalisé par la masse tumorale.
- risque de retard de la vidange gastrique suite à la compression abdominale
- si la tumeur sécrète des catécholamines : prises en charge similaire à celle d’un phéochromocytome
- si la tumeur ne secrète pas de catécholamines et même si l’enfant ne présentait pas d’hypertension artérielle préopératoire, il est fréquent que la manipulation de la tumeur provoque des accès hypertensifs qui sont traités en approfondissant l’anesthésie ou en administrant un vasodilatateur de courte durée d’action (nicardipine, sulfate de magnésium, nitroprussiate de Na, par exemple).
- il est fréquent que l’exérèse de la tumeur soit suivie d’une hypotension artérielle importante due soit à un retard de remplissage masqué par la vasoconstriction, soit à la brusque interruption de la production d’agents vasoactifs : cette hypotension répond en général au remplissage vasculaire mais il faut parfois administrer un vasoconstricteur de manière temporaire
- monitorage invasif de la pression artérielle, pression veineuse centrale, sonde urinaire
- en cas de tumeur abdominale, il est préférable de placer les voies veineuses aux membres supérieurs pour pouvoir continuer à assurer un remplissage vasculaire efficace en cas de clampage de la VCI.
- en l’absence de troubles de l’hémostase, il est utile d’associer un bloc épidural à l’anesthésie générale. Le rapport risque/bénéfice de la technique doit cependant être individualisé car la présence d’une tumeur abdominale entraîne un risque accru d’effraction veineuse (circulation collatérale par le réseau veineux épidural) et d’hypotension majeure à la levée du bloc sympathique qui compense la compression de la veine cave inférieure (comme durant le dernier trimestre de la grossesse). Il est parfois prudent, dans ces cas, de ne réaliser l'injection épidurale qu’après l’exérèse de la tumeur. Il faut également s’assurer de l’absence de métastases vertébrales ou d’envahissement tumoral du canal vertébral.
- en cas de tumeur thoraco-abdominale englobant l’aorte thoracique avec un risque d’atteinte de l’artère d’Adamkiewicz durant la dissection chirurgicale, certaines équipes placent préopératoire un drainage lombaire du LCR afin de diminuer le risque d’ischémie médullaire
- si la tumeur abdominale est petite et bien délimitée (stade 1 ou 2), il est possible d’en réaliser l’exérèse sous laparoscopie. En cas de tumeur abdominale de stade 3 ou 4, l’intervention peut être longue et délicate, et parfois plus mutilante que prévu : ainsi, il faut parfois réaliser une néphrectomie, une pancréatectomie ou une colectomie partielle.
- étant donné les pertes liquidiennes importantes, il peut être utile de faire séjourner l’enfant aux soins intensifs en postopératoire. En cas de tumeur abdominale proche des gros vaisseaux, il n’est pas rare que la période postopératoire se complique d’une lymphorrhée ou même d’une ascite chyleuse.
- en cas de métastase mandibulaire: risque d’intubation difficileil arrive aussi que l’enfant présente une hyperthermie peropératoire importante qui semble être liée à l’hypermétabolisme secondaire à la décharge de catécholamines et qui peut être difficile à distinguer d’une crise d’hyperthermie maligne.
Références :
- Joseph T, Olivier B, Magnier S, Brugières L, Casasoprana A.
Myocardiopathie dilatée aux catécholamines dans le neuroblastome.
Arch Pédiatr 1997 ; 4 : 32-5.
- Goldsby RE, Matthay KK.
Neuroblastoma : evolving therapies for a disease with many faces.
Pediatric Drugs 2004; 6: 107-22.
- Seefelder C, Sparks JW, Chirnomas D, Diller L, Shamberger RC.
Perioperative management of a child with severe hypertension from a catecholamine secreting neuroblastoma.
Pediatr Anesth 2005; 15: 606-10.
- Tobias JD.
Preoperative blood pressure management of children with catecholamine-secreting tumors : time for a change.
Pediatr Anesth 2005; 15: 537-40.
- Mayhew JF.
Intraoperative hyperthermia in a child with neuroblastoma.
Pediatr Anesth 2006; 16: 890-1.
- Hernandez MR, Shamberger RC, Seefelder C.
Catecholamine-secreting neuroblastoma in a 4-month-old infant: perioperative management.
J Clin Anesth 2009; 21: 54-6.
- Dhir S, Wheeler K.
Neonatal neuroblastoma.
Early Human Dev 2010; 86:601-5.
- Thillaivasan A, Arul GS, Thies K-C.
Vasopressin for the treatment of catecholamine-resistant hypotension during pheochromocytoma repair in a 6-year-old child.
Eur J Anaesthesiol 2010; 27: 991-2.
- Wang C, Xin W, Ji Y.
Hyperthermia in a pediatric patient with neuroblastoma during anesthesia: a case report.
BMC Surg 2021; 21:112 doi: 10.1186/s12893-021-01124-3
- do Amaral-Silva GK, Leite AA. Mariz BALA et al.
Metastatic neuroblastoma to the mandible of children: report of two cases and critical review of the literature.
Head and Neck Pathol 2021 ; 15 :757-68
- Fu W, Church J, Garton H, Geiger J, Newman E.
Pre-operative lumbar drain placement: a technique for minimizing ischemic spinal cord injury during neuroblastoma resection.
J Pediatr Surg 2022; 57:1443-5
- Gao S, Dong Y.
Acute left heart failure with pulmonary edema during resection of pediatric neuroblastoma: case report.
Brazil J Anesthesiol 2022;72:156-8
- Liu J, Zurakowski D, Weldon C, Umaretiya P, Holzman R, LinY-C.
Perioperative hypertension and anesthetic management in patients undergoing resection of neuroblastoma.
Pediatr Anesth 2023;33: 577- 82.
- Larkins M, Iasiello J,Travia K, Pasli M,Cai S, Hutton A.
Implementation of the American Society of Anesthesiologists 2022 paediatric guidelines in a child with mandibular metastasis.
Anaesthesia Reports 2024; 12, e12274
Mise-à-jour février 2024