(tumeur de Wilms)
Forme la plus fréquente de cancer du rein: 5-14 % des tumeurs solides de l'enfant, et 90 % des tumeurs du rein de l’enfant. Le pic de fréquence se situe vers 3-4 ans, sans distinction de sexe. Les formes bilatérales concernent 5,6 % des cas. Un néphroblastome hétérolatéral apparaît dans 1 à 3 % des cas opérés avec succès d’une première tumeur.
On distingue des formes :
- sporadiques : la grande majorité des cas,
WT1 [MIM 194 070] : mutation du gène WT1 (11p13), ou, plus rarement du gène BRACA2 (13q13.1) ou une mutation somatique du gène GPC3 (Xq26 .2) ou du gène WTX (Xq11.2)
WT2 [MIM 194 071]: mutation du gène ICR1 (11p15.5)
WT3 [MIM 194 090] : mutation en 16q
WT4 [MIM 601 363] : mutation en 17q12-q21
WT5 [MIM 601 583]: mutation du gène POU6F2 (7p14)
WT6 [MIM 616 806]: mutation du gène REST (4q12)
- familiales (1,5 % des cas) : ces formes sont associées à des mutations des gènes FWT-1 (17q) ou FWT-2 (19q)
- syndromiques, constituant environ 10 % des cas, que l'on classe en deux groupes selon qu'il y a ou non une hypertrophie corporelle.
Les principales formes syndromiques avec hypertrophie corporelle sont :
- le syndrome de Beckwith-Wiedemann (10 à 20 % d’entre eux présentent un néphroblastome) ; mutation du gène ICR1 (11p15.5)
- l’hémihypertrophie corporelle (3 à 5 % d’entre eux présentent un néphroblastome)
- le syndrome de Sotos ou gigantisme cérébral : mutations du gène NSD1 (5q35) ; il existe quelques rares formes non NSD1
- le syndrome de Perlman, associant dysmorphie faciale, gigantisme, dysplasie rénale (hamartomes) et hyperplasie des îlots de Langerhans ;
- le syndrome de Simpson-Golabi-Behemel (mutation somatique du gène GPC3 en Xq26.2), phénotypiquement similaire au Beckwith-Wiedemann.
Les principales formes syndromiques sans hypertrophie corporelle sont :
- l’aniridie congénitale ;
- le syndrome de Denys-Drash, qui associe un pseudohermaphrodisme, une néphropathie avec syndrome néphrotique et un gonadoblastome : gène WT-1 (11p13) ;
- le syndrome WAGR (acronyme de "Wilm's tumor, Aniridia, Genito-urinary abnormalities or Gonadoblastoma, and mental Retardation" où le néphroblastome est associé à une aniridie, des malformations urogénitales et un retard mental ; gène WT-1 (11p13)
- la trisomie 18.
La moitié des enfants porteurs d’une mutation du gène WT1 sont également porteurs de mutations du gène CTNNB1 qui code la béta-caténine.
La tumeur se développe à partir du blastème métanéphrotique ftal. Le degré de maturation cellulaire est corrélé au pronostic : on distingue trois groupes de formes histologiques différentes (à bas, intermédiaire ou haut risque) qui permettent d’adapter le traitement post-opératoire. Il existe une forme dite rhabdomyomateuse (10 %) qui atteint les enfants plus jeunes.
Présentation clinique :
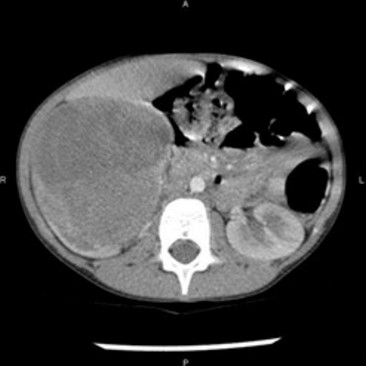
- volumineuse masse abdominale avec augmentation parfois considérable du périmètre abdominal,
- douleurs abdominales dans 1/3 des cas seulement,
- anémie, fièvre, hématurie
- une hypertension artérielle est observée dans 1/3 des cas : elle est due à la sécrétion de rénine soit par le tissu tumoral soit par compression de l’artère rénale.
- des métastases pulmonaires chimiosensibles sont souvent présentes (90 %) lors du bilan initial ; on peut également observer des métastases hépatiques (15 %), abdominales (5 %), osseuses (4 %) ou ganglionnaires (4 %).
Un syndrome paranéoplasique à type de maladie de von Willebrand acquis s’observe dans environ 8 % ces cas de néphroblastome : il s’agit le plus souvent d’une anomalie biologique sans retentissement clinique mais des cas de diathèse hémorragique ont été décrits. Il est donc important de vérifier l’hémostase avant la chirurgie.
L'échographie confirme l'existence d'une volumineuse masse tumorale solide d’origine rénale et doit en identifier la vascularisation veineuse, et rechercher un éventuel thrombus de la veine rénale qui peut remonter jusqu'à l'oreillette droite. Le stade de gravité est établi à partir des données de l'IRM et de la tomodensitométrie.
Des localisations extrarénales peuvent se développer à partir de reliquats du métanéphros : elles sont plus fréquentes dans le rétropéritoine mais des localisations utérines, ovariennes, inguinales et thoraciques ont été décrites. Les formes rétropéritonéales peuvent être la cause de compression médullaire par envahissement du canal vertébral (tumeur en sablier).
|
Stade de gravité |
Caractéristiques |
Taux de survie
|
|
Grade 1 |
La tumeur est limitée à la capsule rénale et complètement retirée chirurgicalement |
95 % |
|
Grade 2 |
La tumeur présente une extension extra-rénale et a été complètement retirée |
> 90 % |
|
Grade 3 |
Ablation incomplète de la tumeur, sans métastases |
<60 % |
|
Grade 4 |
Présence de métastases d'origine hématogène |
< 10 % |
|
Grade 5 |
Tumeur bilatérale |
0 % |
Classification du degré de gravité des tumeurs de Wilms
En Europe, la stratégie thérapeutique est : chimiothérapie (Actinomycine D et vincristine), chirurgie et ensuite chimiothérapie avec ou sans radiothérapie.
L'abord chirurgical se fait par une incision abdominale transversale large (ou une chirurgie robotique) et pour identifier et isoler le pédicule rénal. La tumeur est en général volumineuse et fragile. La dissection en est extensive, difficile, longue et hémorragique.
En cas d’envahissement de la veine cave inférieure ou de l’OD, il peut être nécessaire de réaliser l’intervention sous CEC.
Les tumeurs très volumineuses nécessitent parfois de débuter une chimiothérapie en préopératoire, ce qui réduit leur taille, diminue la taille du thrombus de la veine rénale (voire le fait disparaître) mais peut compliquer les suites opératoires et gêner fortement la cicatrisation.
Implications anesthésiques:
La présence d’une tumeur abdominale importante a des conséquences comme des problèmes respiratoires, une compression de la VCI et un retard de vidange gastrique.
Préopératoire : contrôle de l’hémogramme et de l’hémostase (syndrome paranéoplasique ?), échocardiographie (chimiothérapie, séquelles d’une HTA) pour évaluer la fonction myocardique ;
Monitorage : mesure invasive de la pression artérielle, cathéter veineux central, sonde urinaire. Il est préférable de placer les voies veineuses aux membres supérieurs pour pouvoir continuer à assurer un remplissage vasculaire efficace en cas de clampage de la VCI. Prévention de l’hypothermie.
En l’absence de troubles de l’hémostase, il est utile d’associer un bloc épidural à l’anesthésie générale. Le rapport risque/bénéfice de la technique doit être individualisé car la présence d’une tumeur abdominale entraîne un risque accru d’effraction veineuse (circulation collatérale par le réseau veineux épidural) et d’hypotension majeure à la levée du bloc sympathique qui compense la compression de la veine cave inférieure (comme durant le dernier trimestre de la grossesse). Il est parfois prudent, dans ces cas, de ne réaliser l'injection épidurale qu’après l’exérèse de la tumeur. Il faut également s’assurer de l’absence de métastases vertébrales ou d’envahissement tumoral du canal vertébral. Garder à l’esprit la toxicité nerveuse de la vincristine.
Références :
- Przybylo HJ, Stevenson GW, Backer C, Luck SR, Webb CL, Morgan E, Hal SC.
Anesthetic management of children with intracardiac extension of abdominal tumors.
Anesth Analg 1994; 78:172-5.
- Poerink-Stockschlader ABJ, Dekker I, Risseuw-Appel IM, Hahlen K.
Acquired von Willebrand disease in children with Wilms tumor.
Medical and Pediatric Oncology 1996 ; 26 :238-43.
- Cojean N, Entz-Werle N, Eyer D, Becmeur F, Kehrli P, Marcellin L, Christmann D, Babin A, Lutz P.
Néphroblastome en sablier: une cause inhabituelle de compression médullaire.
Arch Pédiatr 2003 ; 10:1075-8.
- Whyte SD, Ansermino JM.
Anesthetic considerations in the management of Wilms tumor.
Pediatr Anesth 2006; 16:504-13.
- Baxter PA, Nuchtern JG, Guillerman RP, Mahoney DH t al.
Acquired von Willebrand syndrome and Wilms tumor : not always benign.
Pediatr Blood Cancer 2009 ; 52 :392-4
- Granger J, Gidvani VK.
Acquired Factor VII deficiency associated with Wilms tumor.
Pediatr Blood Cancer 2009 ; 52 :394-5
- Sarhan OM, El-Baz M, Sarhan MM, Ghali AM, Ghoneim MA.
Bilateral Wilms' tumors: single-center experience with 22 cases and literature review.
Urology 2010; 76:946-51.
- Martínez CH, Dave S, Izawa J.
Wilms' tumor.
Adv Exp Med Biol 2010; 685:196-209.
- Miura H, Kawana S, Sugino S, Kikuchi C, Yamauchi M.
Successful management of an infant with hypertensive heart failure associated with Wilms tumor : a case report.
JA Clinical Reports 2020 ; 6 :12, doi/10.1186/s40981-020-00318-7
Mise-à-jour: février 2021