Différentes affections hépatiques chroniques du foie dont la cirrhose peuvent provoquer chez certains patients, y compris de jeunes enfants (prévalence : 2 à 8 %), une modification de la vascularisation pulmonaire qui entraîne une anomalie des échanges respiratoires appelée syndrome hépato-pulmonaire. La physiopathologie de cette anomalie est une vasodilatation pulmonaire anormale et une altération de la distribution de la ventilation et de la perfusion. Cette pathologie peut également apparaître en cas de shunts porto-systémiques congénitaux ou au décours d’une opération de Fontan suite à l’hyperpression veineuse hépatique.
Le diagnostic de syndrome hépato-pulmonaire repose sur la présence de la triade:
- insuffisance hépatique, parfois modérée car il n’y a pas de corrélation entre la sévérité de l’hypoxémie et celle de l’insuffisance hépatique, associée à une hypertension portale ;
- hypoxémie modérée à sévère (PaO2 à l’air < 70 mmHg ou SpO2 < 94 %) avec orthodéoxie (qui s’aggrave en position debout : la SpO2 diminue de plus de >5 % en position debout par rapport à la position couchée) ; un hippocratisme digital est fréquent ;
- vasodilatation pulmonaire qui entraîne une réponse faible à l’administration de 100 % d’O2.
En présence d’une insuffisance hépatique et/ou d’une hypertension portale, la diminution de la dégradation hépatique de substances vasodilatatrices (glucagon, NO…) entraîne une vasodilatation au niveau de la microvascularisation pulmonaire et, ainsi, une augmentation du gradient alvéolo-artériel corrigé pour l’âge (avec ou sans hypoxémie).
Trois mécanismes physiopathologiques, souvent associés, sont possibles :
- présence d’un shunt vrai, lié à des anastomoses artérioveineuses intrapulmonaires ou porto-pulmonaires : cette situation est rare chez l’enfant en l’absence d’atrésie portale ; l’administration de 100 % d’O2 ne permet pas d'atteindre une PaO2 de 150 mmHg; on parle alors de syndrome hépato-pulmonaire type II qui peut être en partie corrigé par l’embolisation des anastomoses de gros calibre.
- augmentation du shunt physiologique intrapulmonaire due à une mauvaise répartition de la ventilation et de la perfusion par inhibition de la vasoconstriction hypoxique ;
- diminution de la diffusion d'O2 au niveau des capillaires pulmonaires très larges car dilatés (diamètre normal 8-15 µm contre 50-80 µ en cas de syndrome hépato-pulmonaire); en présence des anomalies 2) et 3), on parle de syndrome hépato-pulmonaire type I.
Dans ces deux derniers cas, la réponse à l’administration de 100 % d’O2 est une augmentation de la PaO2 > 300 mmHg. L’orthodéoxie (diminution > 5% de la SpO2 en passant de la position couchée à la position debout ou assise) s’explique par le fait que la vasodilatation prédomine aux bases pulmonaires : le shunt y augmente donc en position debout.
Sévérité: modérée si PaO2 60-79 mmHg
sévère si PaO2 50-59 mmHg
très sévère si PaO2 ≤ 50 mmHg
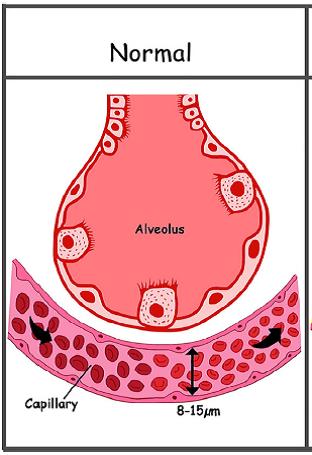
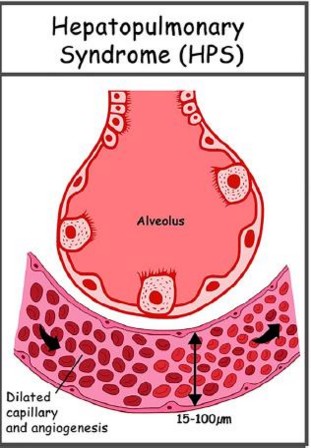
Les causes possibles d’hypoxémie sont nombreuses chez l’insuffisant hépatique :épanchement pleural, ascite importante, infection bronchopulmonaire, hypoventilation alvéolaire, hypertension artérielle pulmonaire, cardiopathie cyanogène associée.
Outre la réponse à l’administration de 100 % d’O2 ou l’inhalation de gaz inertes pour mesurer le shunt pulmonaire, qui sont difficiles à réaliser chez l’enfant, les examens complémentaires suivants peuvent être réalisés pour confirmer la présence d’un syndrome hépato-pulmonaire :
- en médecine nucléaire : on mesure le rapport R entre la captation cérébrale et la captation pulmonaire 20 min après l’injection de microaggrégats d’albumine marquée au Tec99 :
- si R < 1 : absence de shunt,
- si R est compris entre 1 et 2 : résultat douteux ou syndrome hépato-pulmonaire infraclinique,
- si R est compris entre 4 et 20% : il existe un shunt modéré ; il s'agit d'un syndrome hépatopulmonaire léger,
- si R est compris entre 21 et 40% : syndrome hépato-pulmonaire modéré
- si R > 40 % : syndrome hépato-pulmonaire sévère
- par l’échographie cardiaque avec injection intraveineuse de NaCl 0,9% agité (ce qui provoque des microbulles et un effet de contraste) : la sonde d’échographie est placée de manière à voir les deux oreillettes. On voit les microbulles passer dans l’OD et on recherche leur passage dans l'OG :
- absence de microbulles dans l’OG : image normale, il n'y a pas de shunt ;
- s'il apparaît des microbulles dans l’OG dans un délai très court (<3 cycles), il y a un shunt intrapulmonaire ;
- si l’on voit apparaître des microbulles dans l’OG 3 à 6 battements après leur apparition dans l’OD, il y a un syndrome hépato-pulmonaire.
Cet examen est difficile à réaliser chez l’enfant tachycarde mais est plus sensible que celui réalisé en médecine nucléaire car il permet de détecter les stades précoces (sans hypoxémie) du syndrome hépato-pulmonaire. Certains préconisent de ne réaliser ces examens que chez l’enfant dont la SpO2 à l’air est inférieure à 94 %.
Le traitement médical est peu efficace : diverses molécules ont été essayées comme le bismésylate d’almitrine ou l’octéotride mais leur efficacité est limitée. Un shunt porto-systémique transjugulaire (TIPS) a parfois été utilisé de manière transitoire. Le seul traitement curatif est la transplantation hépatique mais l’affection récidive en cas de rejet ou de thrombose portale.
NB: une forme particulière de syndrome hépato-pulmonaire de type II n’est pas liée à une affection hépatique. Il s’agit de l’apparition de fistules artério-veineuses pulmonaires après la réalisation d’un shunt cavo-pulmonaire bidirectionnel de Glenn. Ces fistules disparaissent progressivement lorsque le retour veineux sanguin hépatique passe à nouveau par les artères pulmonaires (circulation de Fontan).
Implications anesthésiques:
La prise en charge anesthésique d’un enfant souffrant d’un syndrome hépato-pulmonaire implique :
- l'ajustement de la FiO2 de manière à obtenir une SpO2 > 88 % ;
- l'absence de ventilation en O2 pur (qui favorise les atélectasies) ;
- le maintien d'une légère PEEP ;
- le remplacement précis des pertes volémiques : il faut éviter l’hypovolémie et l’anémie mais aussi un remplissage vasculaire excessif (risque d’dème pulmonaire) ;
- en cas d’hypotension, utiliser la noradrénaline
- le sevrage rapide du respirateur en fin d’intervention.
- Pièges:
1) un hypoxémie réfractaire peut apparaître dans les premières heures après une transplantation hépatique (SpO2 < 85% malgré FiO2 =1 et PEEP). Elle est sans doute due à la vasoconstriction de vaisseaux pulmonaires en présence de médiateurs hépatiques. Essayer successivement: mise en Trendelenbourg, administration de NO ou époprosténol, bleu de méthylène, embolisation des artères encore dilatées, ECMO. Mortalité importante (45%)
2) la vasodilatation pulmonaire peut masquer une hypertension porto-pulmonaire débutante (voir ce terme) qui n’apparaîtra qu’après la greffe hépatique
Références :
- Al-Hussaini A,Taylor RM, Samyn M, Bansal S, Heaton N, Rela M, Mieli-Vergani G, Dhawan A.
Long-term outcome and management of hepatopulmonary syndrome in children.
Pediatr Transplant 2010; 14:276-82. - Mazzeo AT, Lucanto T, Santamaria LB.
Hepatopulmonary syndrome: a concern for the anesthetist ? Preoperative evaluation of hypoxemic patients with liver disease.
Acta Anaesthesiol Scand 2004; 48:178-86. - Van Obbergh LJ, Carlier M, De Kock M, Otte JB, Moulin D, Veyckemans F.
Hepatopulmonary syndrome and liver transplantation: a review of the perioperative management of seven paediatric cases.
Paediatr Anaesth 1998; 8:59-64.
- Karrer FM, Wallace BJ, Estrada AE.
Late complications of biliary atresia: hepatopulmonary syndrome and portopulmonary hypertension.
Pediatr Surg Int 2017; 33: 1335-40. - Lee WS, Wong SY, Ivy D, Sokol RJ.
Hepatopulmonary syndrome and portopulmonary hypertension in children: recent advances in diagnosis and management.
J Pediatr 2018; 196; e14-21. - Sonavane AD, Badge A, Raur V, Marar S, Sawant A et al.
Therapeutic coil embolization of dominant shunt in hepatopulmonary syndrome enhances post-liver transplant respiratory recovery.
Pediatr Transplant 2020; 24: e 13729 - Gendera K, Eicken A, Ewert P.
Spontaneous closure of arterio-venous pulmonary fistulas by redirection of hepatic venous blood 9 years after Glenn anastomosis in a 12-year-old girl.
Cardiology in the Young 2019; 29:1287-9 - Fauconnet P, Klopfenstein CE, Schiffer E.
Hepatopulmonary syndrome: the anaesthetic considerations.
Eur J Anaesthesiol 2013; 30 :721-30. - Nayyar D, Man HSJ, Granton J, Lilly JB, Gupta S.
Proposed management algorithm for severe hypoxemia after liver transplantation in the hepatopulmonary syndrome.
Am J Transplantation 2015; 15: 903–13
Mise-à-jour juillet 2022