Rare. Fait partie des malformations bronchopulmonaires dérivées embryologiquement de l'intestin antérieur. Il existe nette prédominance masculine: 60 à 70% des cas.
La cause en est un rétrécissement de la lumière bronchique suite à l’absence ou au caractère anormal du cartilage bronchique : cela entraîne un collapsus bronchique à l’expiration (bronchomalacie) et, par un effet de valve unidirectionnelle, la rétention croissante d’air dans le parenchyme d’aval. L’anomalie du cartilage peut être due à:
- une hypoplasie ou agénésie constitutionnelle des cartilages bronchiques,
- une anomalie de la composition du cartilage bronchique (anomalie de l’élastine),
- une fibrose intra-utérine de l’interstitium des parois bronchiques,
- une compression bronchique extrinsèque par une volumineuse artère pulmonaire durant la vie ftale : les anneaux cartilagineux, comprimés durant une longue période, sont malformés.
Dans 50 % des cas, on ne retrouve pas le facteur causal. Dans 10% des cas, il existe des malformations associées, principalement des cardiopathies congénitales. On a rapporté quelques cas familiaux dominés par une hypoplasie des cartilages bronchiques et suggérant une transmission autosomique dominante.
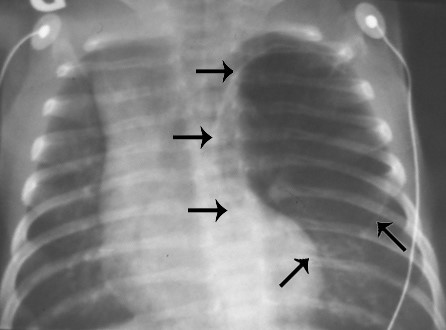
L’affection se traduit par la surdistension habituellement unilatérale d'un lobe pulmonaire (par dystrophie tissulaire), lobe supérieur gauche (41% des cas), lobe moyen droit (34%) ou lobe supérieur droit (21%). Il en résulte un déplacement du médiastin et une compression du poumon opposé.
La présentation clinique de l'affection est variable et dépend du volume de la dilatation du lobe pulmonaire qui peut entraîner un déplacement du médiastin et obstruer le retour veineux intrathoracique. Les symptômes sont similaires à ceux d'un pneumothorax sous tension avec dyspnée sévère, cyanose, tirage, sibilances et détresse respiratoire dont l’importance est fonction du degré de compression des structures normales par le parenchyme pulmonaire dystrophique.
Lorsque la détresse respiratoire est sévère, l'indication chirurgicale devient très urgente. La chirurgie peut s'effectuer par thoracotomie classique en décubitus latéral sur le côté sain ou par thoracoscopie.
Dans les formes moins sévères, avec détresse respiratoire modérée, on peut tenter un traitement conservateur, en assurant une ventilation avec de faibles pressions et volumes pour éviter l’hyperinflation du lobe atteint ou en effectuant une intubation sélective du poumon sain de manière à laisser le lobe lésé se vider progressivement.
Diagnostic différentiel : anomalie vasculaire (anneau vasculaire), maladie adénomatoïde, kyste bronchogénique, bronchomalacie et/ou obstruction intra-bronchique. La radiographie pulmonaire montre une hyperinflation aérique du lobe pulmonaire concerné, un shift médiastinal et un aplatissement de l'hémidiaphragme homolatéral
Implications anesthésiques:
échocardiographie préopératoire; monitorage invasif et l'isolement du poumon atteint avec une ventilation pulmonaire unilatérale. Induction soit par inhalation d'halogéné soit par voie veineuse, mais en conservant la ventilation spontanée et en évitant absolument l'utilisation de N2O. La trachée est intubée sans curarisation préalable et la ventilation spontanée est préservée jusqu'à l'exclusion du poumon lésé ou l'ouverture du thorax. La précaution essentielle est d'éviter toute surpression bronchique lors de la ventilation jusqu'à l'exclusion lobaire pour éviter d'aggraver la surdistension du lobe pulmonaire lésé par effet de valve
L'isolement pulmonaire du côté opposé à la lésion peut être réalisé par l'intubation sélective de sa bronche souche sous fibroscopie ou par exclusion de la ventilation du côté atteint par un cathéter de Fogarty ou par un bloqueur bronchique positionné sous contrôle fibroscopique.
S'il survient une hypotension, pendant l'induction comme durant l'entretien, elle est probablement due à la combinaison d’une diminution du retour veineux par l’augmentation de pression dans le poumon malade et des effets hémodynamiques des agents anesthésiques; il faut réduire la pression de ventilation et la concentration administrée d’agent halogéné. On peut recourir à la kétamine IV (1-2 mg/kg) pour assurer à la fois l'analgésie et une profondeur d'anesthésie suffisante.
Références :
- Ulku R, Onat S, Ozçelik C.
Congenital lobar emphysema: differential diagnosis and therapeutic approach.
Pediatr Int 2008; 50:658-61.
- Ceran S, Altuntas B, Sunam GS, Bulut I.
Congenital lobar emphysema: is surgery routinely necessary?
Afr J Paediatr Surg 2010; 7:36-7.
- Tander B, Yalcin M, Yilmaz B, Ali Karadag C, Bulut M.
Congenital lobar emphysema: a clinicopathologic evaluation of 14 cases.
Eur J Pediatr Surg 2003; 13:108-11.
- Schmidt C, Rellensmann G, Van Aken H, Semik M, Bruessel T, Enk D.
Single-lung ventilation for pulmonary lobe resection in a newborn.
Anesth Analg 2005; 101:362-4.
- Iodice F, Harban F, Walker I.
Anesthetic management of a patient with bilateral congenital lobar emphysema.
Pediatr Anesth 2008; 18: 340-1.
- Gupta R, Singhal SK, Rattan KN, Chhabra B.
Management of congenital lobar emphysema with endobronchial intubation and controlled ventilation.
Anesth Analg 1998; 86: 71-3.
- Subramanyam R Costandi A, Mahmoud M.
Congenital lobar emphysema and tension emphysema.
J Clin Anesth 2016; 29: 17-8.
- Kunisaki SM, Saito JM, Fallat ME, Peter SDS et al.
Current operative management of congenital lobar emphysema in children: a report from the Midwest Pediatric Surgery Consortium.
J Pediatr Surg 2019; 54: 1138-42.
Mise-à-jour novembre 2019