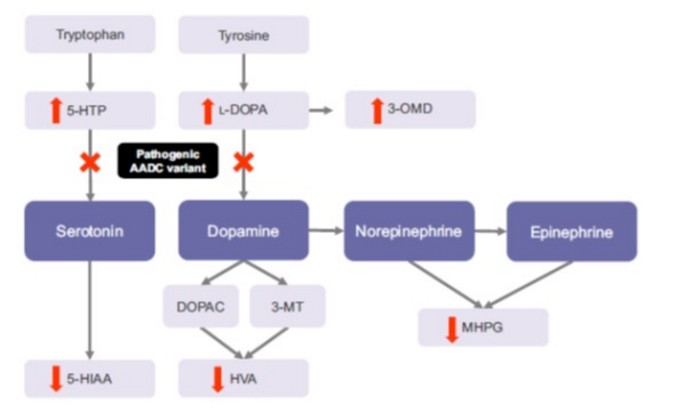
Rarissime : une centaine de cas décrits, surtout chez des patients originaires de la Chine du Sud (Taiwan) et du Japon. Transmission autosomique récessive d’une mutation du gène DDC (17p12.2-p12.1) qui encode la décarboxylase des acides aminés L-aromatiques: cette enzyme pyridoxine-dépendante est nécessaire à la décarboxylation de lévodopa en dopamine (étape de la synthèse de l’adrénaline et de la noradrénaline) et du 5-hydroxytryptophane en sérotonine. Le dysfonctionnement de cette enzyme entraîne donc un déficit en dopamine, épinéphrine et norépinéphrine, et en sérotonine.
Le tableau clinique est fort variable:
- premiers signes durant les premiers mois de vie: hypotonie, crises oculogyres, dystonie, hypokinésie, troubles du système végétatif ;
- retard de développement
- prédominance du tonus vagal : bradycardie, sueurs, ptosis, myosis, congestion nasale, hypotension artérielle, reflux gastro-oesophagien
- trouble du contrôle de la température corporelle : hypo- ou hyperthermie
- irritabilité, cris excessifs, comportement de type autistique
- stridor secondaire à une laryngo- ou trachéomalacie
- les crises dystoniques consistent en des contractions musculaires intenses qui peuvent entraîner des troubles respiratoires ou métaboliques (rhabdomyolyse)
Selon la présentation clinique, on distingue :
- une forme sévère : retard sévère de développement, enfant totalement dépendant
- une forme modérée : retard léger de développement, marche sans assistance,
- une forme intermédiaire
Diagnostic : taux effondré des neurotransmetteurs catécholaminergiques et de leurs métabolites dans le LCR.
Le traitement est symptomatique et doit être individualisé.
Il associe en général:
- un agoniste des récepteurs à la dopamine: par exemple, pramipexole (agoniste des récepteurs à la dopamine): de 6 à 35 µg/kg/j en 2 prises.
- un inhibiteur de la MAO B : sélégiline de 0,1 à 0,25 mg/kg/j en 3-4
- la pyridoxine ou le phosphate de pyridoxal, un cofacteur de décarboxylase des acides aminés la L-aromatiques
Et parfois :
- un anticholinergique central : benztropine, trihexyphénidil en 2 à 4 doses/jour, en cas de dystonie ou de signes parkinsoniens importants
- de la mélatonine en cas de troubles du sommeil, 3 mg avant le coucher
- de l’acide folinique : 1 à 2 mg/kg/j (maximum 20 mg)
- et, seulement dans certaines mutations : de la L-Dopa non associée à un inhibiteur de la dopa-décarboxylase : 0,5 à 5 mg/kg/j en 3 prises
Il faut éviter le 5-hydroxytryptophane et les inhibiteurs de la recapture de la sérotonine, ainsi que les antagonistes centraux de la dopamine comme l’halopéridol et le métoclopramide.
Prudence avec les antagonistes de la sérotonine de type 5 HT3 (ondansétron etc).
Thérapie génique expérimentale : injection unique et bilatérale, par voie stéréotaxique (IRM), chez l’enfant de > 18 mois, d’un vecteur associé à un adénovirus (eladocargene exuparvovec, AAV2- Upstaza®) contenant le gène humain PTC-AADC dans les neurones dopaminergiques du putamen.
Implications anesthésiques:
Salivation importante. Accès veineux périphérique difficile. Poursuivre le traitement médical jusqu’au jour de l’intervention ; ECG et échocardiographie récents ; risque d’hypoglycémie ; diminution de la réponse à l’hypovolémie : en cas d’hypotension, il n’y a pas de réponse à l’éphédrine et la réponse aux amines directes est souvent exagérée : il est préférable d’utiliser des doses titrées de dopamine ou de noradrénaline; éviter les antagonistes centraux de la dopamine comme le métoclopramide et les butyrophénones. Atropine pour contrecarrer le tonus vagal prédominant et éviter les bradycardies ?
Risque d’hypo- ou d’hyperthermie avec sudation profuse.
Interactions médicamenteuses: la sélégiline (inhibiteur de type B de la MAO) n’a en principe pas d’interactions avec les agents anesthésiques à moins de 10 mg/j mais se comporterait comme une IMAO A à doses plus fortes.
On ignore si les sétrons (inhibiteurs 5HT3) peuvent être utilisés comme antiémétiques. Il est préférable d’éviter le tramadol à cause de son mode d’action monoaminergique.
Références :
- Vutskits L, Menache C, Manzano S, Haenggeli CA, Habre W.
Anesthesia management in a young child with aromatic l-amino acid decarboxylase deficiency.
Pediatr Anesth 2006; 16: 82-4.
- Berkowitz DH, Ganesh A.
Combined general and regional anesthetic in a child with aromatic L-amino acid decarboxylase deficiency.
Anesth Analg 2006;103:1630-1.
- Anselm IA, Darras BT.
Catecholamine toxicity in aromatic L-amino acid decarboxylase deficiency.
Pediatr Neurol 2006; 35: 142-4.
- Wassenberg T, Molero-Luis M, Jeltsch K, et al.
Consensus guideline for the diagnosis and treatment of aromatic l-amino acid decarboxylase (AADC) deficiency.
Orphanet J Rare Dis 2017;12:12.
- Viviani C, Buelli E, Fierro G, Stiffan S, Lorini FL.
Anesthesia management for cesarean delivery in a woman with aromatic l-amino acid decarboxylase deficiency : a case report.
A&A Practice ; 2020 ; 14 : e01275
- McCarthy A, Black C.
Anaesthesia management of a child with aromatic L-amino acid decarboxylase deficiency.
Anaesthesia Reports 2022 ; 10 : e12152
- Roubertie A, Opladen T, Brennenstuhl H, et al.
Gene therapy for aromaticL-amino acid decarboxylase deficiency: requirements for safe application and knowledge-generating follow-up.
J Inherit Metab Dis 2023;1‐13. doi.org/10.1002/jimd.12649
- Kanjia MK, Jooste EH, Illig M, et al.
Optimizing the anesthetic care of patients with aromatic l-amino acid decarboxylase deficiency.
Pediatr Anesth 2025; 35:99-106 doi:10.1111/pan.15025
- Clariot S, Gras S, Goetz L, Boulloud C, Bonheur J, Vayssiere P, D'Hardemare V, Ravelli C, Dorison N, Devys J-M.
Case series of anesthetic management of gene therapy in children with aromatic L-Amino Acid Decarboxylase deficiency.
Pediatr Anesth 2025; 35:316-20
Mise à jour mars 2025