(esophageal lung)
Très rare (< 200 cas publiés). Communication anormale, d’origine congénitale, entre l’œsophage et une bronche souche, lobaire ou segmentaire (droite dans 95% des cas) : en cas de connexion directe à une bronche souche on parle de poumon oesophagien. Elle est due à un trouble de l’embryogenèse entre le 32ème et le 41ème jour de vie. L’origine est multifactorielle avec peut-être une prédisposition génétique. Le poumon correspondant à la bronche est soit du poumon hypoplasique soit un séquestre extralobaire. La vascularisation peut être systémique (aorte et veine cave inférieure, porte ou azygos) ou pulmonaire ou mixte. D’autres malformations, surtout oesophagiennes, sont souvent associées : atrésie de l’œsophage avec ou sans fistule, VACTERL
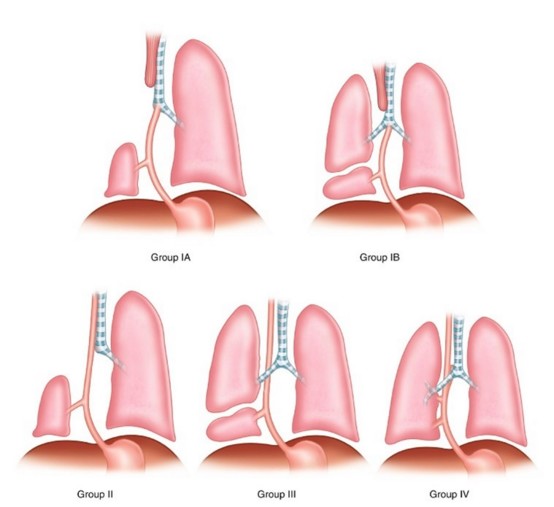
On distingue 4 groupes :
- I (16 %) : associé à une atrésie de l'oesophage avec ou sans fistule oesotrachéale,
* Ia : tout le poumon est connecté à la bronche qui provient de l’oesophage ou de l’estomac
* Ib : une partie du poumon est connectée à la bronche qui provient de l’œsophage ou de l’estomac
- II (33 %) : tout le poumon est connecté à la bronche souche qui provient de l’oesophage
- III (46 %) : une partie du poumon (séquestre extralobaire) est connectée à la bronche qui provient de l’œsophage ou de l’estomac ; vascularisation par l’aorte ou par une branche hypoplasique de l’artère pulmonaire.
- IV (5 %): une partie de l’arbre bronchique normal (lobe inférieur droit (43 %) ou gauche (22 %)) communique avec l’œsophage (2/3 inférieurs) ; la partie du poumon dont provient la bronche a une vascularisation systémique.
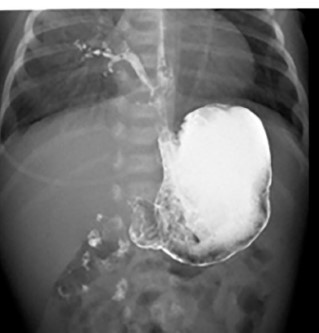
Présentation clinique : détresse respiratoire néonatale ou plus tardive, découverte lors de la cure d’une atrésie de l’œsophage, infections respiratoires récidivantes. La malformation n’est parfois découverte que dans l’enfance (infections, atélectasie persistante, hémoptysie) ou à l’âge adulte (trajet oblique, présence d’un effet valve ?).
Diagnostic : RX, échographie, opacification ou endoscopie oesophagienne.
Traitement : résection du tissu pulmonaire anormal ou du séquestre, ou réimplantation de la bronche sur la trachée si le tissu pulmonaire est normal et le diagnostic précoce.
Implications anesthésiques:
détresse respiratoire, thoracotomie (ou -scopie) et ventilation unipulmonaire chez un nouveau-né ou un nourrisson ; malformations associées.
Dans un cas : ventilation unipulmonaire, via la trachée, du poumon normal et ventilation via l’œsophage (intubé) du poumon relié à l’œsophage jusqu’au moment de l’anastomose de la bronche oesophagienne sur la trachée.
Références :
- Srikanth MS, Ford EG, Phillip S, Mahour GH.
Communicating bronchopulmonary foregut malformations: classification and embryogenesis.
J Pediatr Surg 1992; 27: 732-6.
- Michel JL, Revillon Y, Salakos C, De Bloc J, Jan D, Beringer A, Scheinmann P.
Successful bronchotracheal reconstruction in esophageal bronchus: two case reports.
J Pediatr Surg 1997; 32:739-42.
- Peuch C, Malbezin S, Saizou C, Couloigner V, Elmaleh M, Nivoche Y, de Lagausie P, Laundenbach V.
Separate-lung ventilation strategy for reimplantation of esophageal bronchus.
Anesth Analg 2002; 95 : 333-5.
- Désir A, Ghaye B.
Congenital abnormalities of the intrathoracic airways.
Radiol Clin N Am 2009; 47: 203–25
- Sugandhi N, Sharma P, Agarwala S, Kabra SK, Gupta AK, Gupta DK.
Esophageal lung: presentation, management, and review of literature.
J Pediatr Surg 2011; 46: 1634-7.
- Trisno SL, Higano NS, Kechele D, Nasr T, Chung W, Zorn AM, Woods JC, Wells JM, Kingma PS.
Case report: Esophageal bronchus in a neonate, with image, histological, and molecular analysis.
Frontiers in Pediatrics 2021 ; 9 :707822.
- Patrao FM, Valdez AL, MD, Kanmanthreddy S, Gentry KR, Collins MJ.
Esophageal Bronchus—the hidden Link. A case report.
A&A Practice 2024;18:e01843
Mise-à-jour: octobre 2024